Perbezaan antara penghidrogenan dan pengurangan

The Perbezaan utama antara penghidrogenasi dan pengurangan ialah penghidrogenan memerlukan pemangkin manakala pengurangan tidak memerlukan pemangkin kecuali ia menghidrogenasi. Hidrogenasi adalah satu bentuk tindak balas pengurangan di mana hidrogen molekul menggabungkan dengan molekul sedia ada. Oleh itu, penghidrogenasi dan pengurangan saling berkaitan.
Pengurangan boleh menjadi penurunan bilangan pengoksidaan, kehilangan oksigen atau penambahan hidrogen. Tetapi beberapa tindak balas pengurangan tidak melibatkan oksigen atau hidrogen sebagai reaktan. Oleh itu, definisi yang paling boleh diterima untuk pengurangan adalah penurunan nombor pengoksidaan. Sebagai tambahan kepada perbezaan utama di atas, terdapat beberapa perbezaan lain antara kedua -dua tindak balas kimia seperti komponen tindak balas kimia; molekul yang mempunyai ikatan berganda atau tiga boleh menjalani hidrogenasi manakala mana -mana molekul yang mempunyai atom dengan bilangan pengoksidaan yang lebih tinggi dapat menjalani tindak balas pengurangan.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah hidrogenasi
3. Apa itu pengurangan
4. Perbandingan sampingan - hidrogenasi vs pengurangan dalam bentuk jadual
5. Ringkasan
Apakah hidrogenasi?
Hidrogenasi adalah tindak balas kimia yang merangkumi penambahan hidrogen molekul kepada spesies kimia. Tambahan pula, tindak balas ini biasanya berlaku di hadapan pemangkin; nikel, paladium, platinum atau oksida mereka. Sangat berguna untuk mengurangkan atau menenun sebatian kimia. Hidrogenasi boleh menjejaskan molekul dalam dua cara;
- Tepu sebatian yang mengandungi sama ada ikatan berganda atau tiga
- Penyisihan molekul
Hampir semua sebatian tak tepu mampu bertindak balas dengan hidrogen molekul.
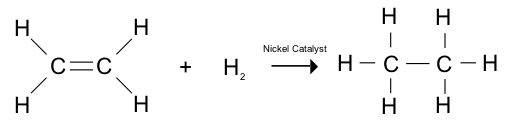
Rajah 01: Hidrogenasi alkena memberi alkana
Reaksi kimia ini berguna dalam banyak tujuan perindustrian untuk sintesis sebatian yang berbeza seperti hidrogenasi berguna dalam industri petroleum untuk pengeluaran petrokimia yang berbeza.
Apa itu pengurangan?
Pengurangan adalah penurunan bilangan pengoksidaan spesies kimia. Reaksi ini adalah reaksi separuh tindak balas redoks (tindak balas redoks mempunyai dua tindak balas kimia yang berlaku selari antara satu sama lain; pengoksidaan dan pengurangan). Tindak balas pengurangan mengurangkan bilangan pengoksidaan sementara tindak balas pengoksidaan meningkatkan bilangan pengoksidaan.
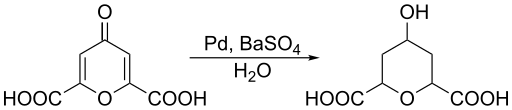
Rajah 02: Pengurangan asid chelidonik
Kadang -kadang, pengurangan adalah penyingkiran oksigen atau penambahan hidrogen kepada spesies kimia. Selain itu, tindak balas jenis ini berlaku dalam tiga cara utama; Kurangkan bilangan pengoksidaan dari nilai positif kepada nilai negatif, dari sifar ke nilai negatif atau dari negatif ke nilai negatif selanjutnya. Contoh umum untuk tindak balas pengurangan adalah penurunan bilangan pengoksidaan tembaga (II) ke tembaga (0).
Apakah perbezaan antara hidrogenasi dan pengurangan?
Hydrogenation adalah tindak balas kimia yang merangkumi penambahan hidrogen molekul kepada spesies kimia. Pengurangan adalah penurunan bilangan pengoksidaan spesies kimia. Tindak balas hidrogenasi dan pengurangan berkaitan dengan satu sama lain kerana penghidrogenasi adalah satu bentuk pengurangan.
Walau bagaimanapun, terdapat beberapa perbezaan antara kedua -dua proses kimia seperti yang diberikan di bawah. Sebagai contoh, penghidrogenan pada dasarnya memerlukan pemangkin untuk perkembangan tindak balas sementara pengurangan tidak memerlukan pemangkin kecuali ia menghidrogenasi. Dan juga, hidrogenasi berlaku dengan molekul tak tepu sementara pengurangan berlaku dengan mana -mana spesies kimia yang mempunyai nombor pengoksidaan yang lebih tinggi.

Ringkasan -Hidrogenasi vs pengurangan
Penghidrogenasi dan pengurangan adalah tindak balas kimia penting yang mempunyai banyak aplikasi dalam industri. Penghidrogenasi adalah satu bentuk pengurangan. Perbezaan antara penghidrogenan dan pengurangan adalah bahawa penghidrogenasi memerlukan pemangkin sedangkan pengurangan tidak memerlukan pemangkin melainkan jika ia menghidrogenasi.
Rujukan:
1. Helmenstine, Anne Marie, PH.D. "Definisi pengurangan dalam kimia."Pemikiran, Sep. 3, 2017. Terdapat di sini
2. "Hidrogenasi."Wikipedia, Yayasan Wikimedia, 25 Mei 2018. Terdapat di sini
Ihsan gambar:
1.'Alkene to Alkane'by Robert di Wikibooks Bahasa Inggeris (Domain Awam) melalui Commons Wikimedia
2.'Pengurangan asid chelidonic'by hbf878 - kerja sendiri, (cc0) melalui commons wikimedia


