Perbezaan antara penghidratan dan penghidrogenan
The Perbezaan utama antara penghidratan dan penghidrogenasi ialah penghidratan merujuk kepada penambahan molekul air ke sebatian organik, sedangkan hidrogenasi merujuk kepada penambahan molekul hidrogen ke sebatian organik.
Penghidratan dan penghidrogenasi penting dalam tindak balas sintesis kimia. Kedua -dua tindak balas ini melibatkan pembukaan ikatan berganda dalam sebatian organik dengan penambahan substituen kepada atom karbon dalam ikatan berganda. Substituen yang ditambah dalam proses ini berbeza antara satu sama lain.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu penghidratan
3. Apakah hidrogenasi
4. Perbandingan sampingan -penghidratan vs penghidrogenan dalam bentuk jadual
5. Ringkasan
Apa itu penghidratan?
Penghidratan adalah penambahan molekul air ke sebatian organik. Sebatian organik biasanya alkena, yang mempunyai ikatan berganda antara dua atom karbon. Molekul air ditambah kepada ikatan berganda ini dalam bentuk kumpulan hidroksil (OH-) dan proton (h+). Oleh itu, molekul air memisahkan ionnya sebelum penambahan ini. Kumpulan hidroksil dilampirkan pada satu atom karbon ikatan berganda manakala proton dilampirkan pada atom karbon yang lain.
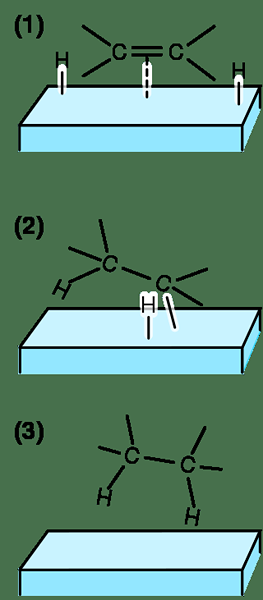
Rajah 01: Reaksi penghidratan mudah
Oleh kerana ia melibatkan pemecahan ikatan dan pembentukan ikatan, tindak balasnya sangat eksotermik. Maksudnya; tindak balas melepaskan tenaga dalam bentuk haba. Ia adalah tindak balas langkah demi langkah; Dalam langkah pertama, alkena bertindak sebagai nukleofil dan menyerang proton molekul air dan mengikat dengannya melalui atom karbon yang kurang diganti. Di sini, reaksi mengikuti peraturan Markonikov.
Langkah kedua termasuk lampiran atom oksigen molekul air ke atom karbon yang lain (atom karbon yang sangat digantikan) dari ikatan berganda. Pada ketika ini, atom oksigen molekul air membawa caj positif kerana ia menanggung tiga ikatan tunggal. Kemudian datang molekul air lain yang mengambil proton tambahan molekul air yang dilampirkan, meninggalkan kumpulan hidroksil pada atom karbon yang kurang digantikan. Oleh itu, tindak balas ini membawa kepada pembentukan alkohol. Walau bagaimanapun, alkynes (ikatan triple yang mengandungi hidrokarbon) juga boleh menjalani tindak balas penghidratan.
Apakah hidrogenasi?
Hidrogenasi adalah proses penambahan molekul hidrogen ke sebatian organik. Selanjutnya, tindak balas ini melibatkan rawatan sebatian organik dengan gas hidrogen. Biasanya, tindak balas berlaku di hadapan pemangkin seperti nikel, paladium atau platinum. Hidrogenasi bukan katalitik hanya mungkin pada suhu yang sangat tinggi. Juga, proses ini penting dalam pengurangan sebatian organik tak tepu. Maksudnya; Hidrogenasi boleh membuka ikatan berganda atau ikatan tiga kali ganda dalam sebatian organik dan menjadikannya sebatian yang mengandungi bon tunggal.
Proses hidrogenasi mempunyai tiga komponen: substrat tak tepu, sumber hidrogen dan pemangkin. Keadaan tindak balas seperti suhu dan tekanan berbeza -beza bergantung kepada jenis sebatian tak tepu dan pemangkin. Substrat boleh sama ada alkena atau alkyne. Hydrogenation boleh berlaku dalam dua cara: pemangkinan homogen dan pemangkinan heterogen.
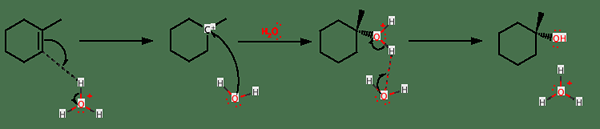
Dalam pemangkinan homogen, logam pemangkin mengikat dengan kedua-dua alkena dan hidrogen untuk memberikan produk perantaraan (kompleks alkena-catalyst-hydrogen). Kemudian pemindahan satu atom hidrogen dari logam ke karbon dalam ikatan berganda (atau ikatan tiga) berlaku. Apa yang berlaku seterusnya ialah pemindahan atom hidrogen yang lain dari sumber hidrogen ke kumpulan alkil dengan pemisahan serentak alkana.

Rajah 02: Tiga langkah hidrogenasi
Dalam pemangkinan heterogen, ikatan tak tepu mengikat dengan pemangkin sementara sumber hidrogen mengalami pemisahan kepada dua atom hidrogen. Kemudian langkah terbalik berlaku di mana satu atom hidrogen mengikat kepada ikatan tak tepu. Akhirnya, tindak balas yang tidak dapat dipulihkan berlaku di mana atom hidrogen lain melekat pada kumpulan alkil.
Apakah perbezaan antara penghidratan dan penghidrogenan?
Penghidratan dan penghidrogenasi adalah proses penting dalam sintesis kimia. Perbezaan utama antara penghidratan dan penghidrogenan ialah penghidratan merujuk kepada penambahan molekul air ke sebatian organik, sedangkan penghidrogenan merujuk kepada penambahan molekul hidrogen ke sebatian organik.
Di bawah infographic meringkaskan perbezaan antara penghidratan dan penghidrogenan.
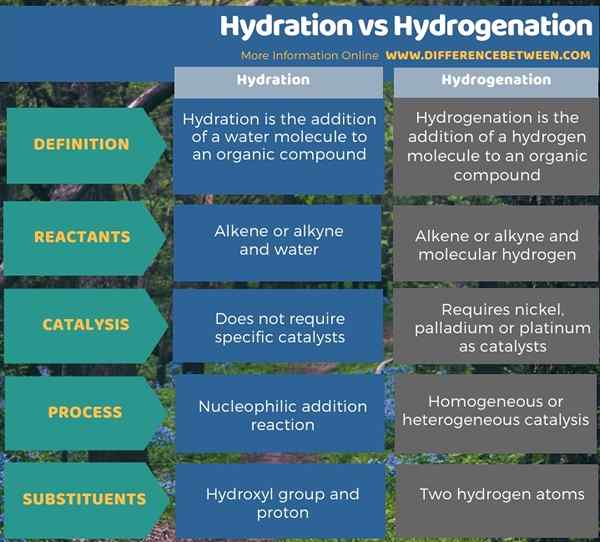
Ringkasan -penghidratan vs penghidrogenan
Penghidratan dan penghidrogenasi adalah proses penting dalam sintesis kimia. Perbezaan utama antara penghidratan dan penghidrogenan ialah penghidratan merujuk kepada penambahan molekul air ke sebatian organik, sedangkan penghidrogenan merujuk kepada penambahan molekul hidrogen ke sebatian organik.
Rujukan:
1. "Spesifikasi untuk elektrod selektif ion, elektrod rujukan, elektrod gabungan dan meter elektrod selektif ion untuk penentuan ion dalam larutan."Doi: 10.3403/00222406U.
Ihsan gambar:
1. "HydrationReaction" oleh Ccroberts - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia
2. "Hydrogenation on Catalyst" oleh Michael Schmid - Lukisan Dicipta diri saya (CC BY -SA 4.0) melalui Commons Wikimedia


