Perbezaan antara orbital hibrid dan merosot
The Perbezaan utama Antara orbital hibrid dan degenerat ialah Orbital hibrid adalah orbital baru yang terbentuk dari pencampuran dua atau lebih orbital, sedangkan orbital yang merosot pada asalnya wujud dalam atom.
Seperti namanya, orbital hibrid adalah hibrid dua atau lebih orbital. Walaupun nama degenerate orbital nampaknya sama, mereka tidak baru terbentuk orbital - mereka sudah wujud dalam atom. Selain itu, semua orbital hibrid dalam molekul mempunyai tenaga yang sama semasa orbital yang merosot dalam atom mempunyai tenaga yang sama.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah orbital hibrid
3. Apakah orbital yang merosot
4. Perbandingan sampingan - hibrid vs orbital yang merosot dalam bentuk jadual
5. Ringkasan
Apakah orbital hibrid?
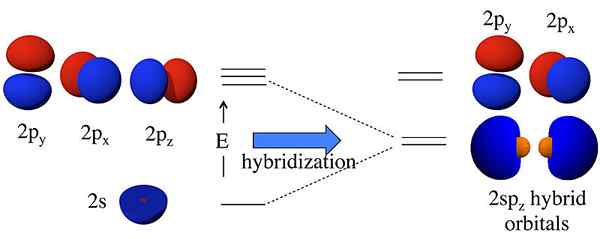
Orbital hibrid adalah orbital yang dibentuk oleh gabungan dua atau lebih orbital atom. Kami memanggil hibridisasi proses gabungan ini. Sebelum pembentukan orbital ini, orbital atom mungkin mempunyai tenaga yang berbeza, tetapi selepas pembentukan, semua orbital mempunyai tenaga yang sama. Sebagai contoh, orbital atom S, dan orbital atom P boleh bergabung untuk membentuk dua orbital SP. Orbital atom S dan P mempunyai tenaga yang berbeza (tenaga S < energy of p). But, hybridization results in the formation of two sp orbitals having the same energy; this energy lies between the energies of individual s and p atomic orbital energies. Moreover, this sp hybrid orbital has 50% s orbital characteristics and 50% p orbital characteristics.

Rajah 01: Hibridisasi SP
Idea hibridisasi pertama kali masuk ke dalam perbincangan kerana saintis mendapati bahawa teori ikatan valensi gagal meramalkan struktur beberapa molekul seperti ch4. Walaupun atom karbon hanya mempunyai dua elektron yang tidak berpasangan mengikut konfigurasi elektron, ia boleh membentuk empat ikatan kovalen. Untuk membentuk empat bon, mesti ada empat elektron yang tidak berpasangan. Satu -satunya cara untuk menerangkan fenomena ini adalah untuk berfikir bahawa S dan P orbitals fius atom karbon antara satu sama lain untuk membentuk orbital baru yang dipanggil orbital hibrid, yang mempunyai tenaga yang sama. Di sini, satu s + tiga p memberikan 4 sp3 orbital. Oleh itu, elektron mengisi orbital hibrid ini secara merata (satu elektron per orbital hibrid), mematuhi peraturan hund. Kemudian, terdapat empat elektron untuk pembentukan empat ikatan kovalen dengan empat atom hidrogen.
Apakah orbital yang merosot?
Orbital Denigrasi adalah orbital atom yang mempunyai tenaga yang sama. Sebagai contoh, dalam subshell orbital, terdapat tiga orbital atom yang berbeza antara satu sama lain mengikut susunan ruang. Walaupun tenaga ketiga -tiga orbital ini adalah sama, mereka diatur secara berbeza; Oleh itu, kami memanggil mereka orbital yang merosot.
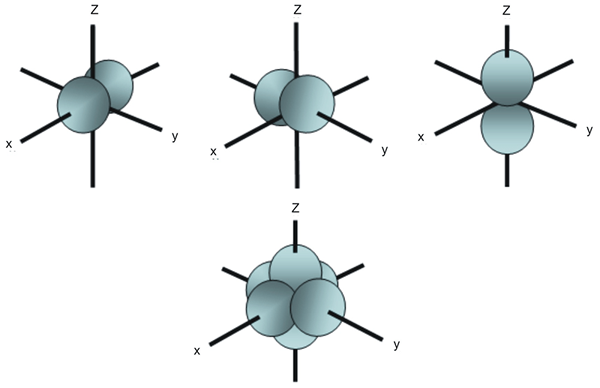
Rajah 02: Susunan ruang tiga orbital p
Walau bagaimanapun, dengan kehadiran medan magnet luaran, kita boleh mengeluarkan degenerasi. Ini kerana orbital yang merosot cenderung untuk mendapatkan tenaga yang berbeza di hadapan medan magnet luaran ini, dan mereka tidak lagi merosot orbital. Tambahan pula, lima orbital D di subshell D juga adalah orbitals yang merosot kerana mereka mempunyai tenaga yang sama.
Apakah perbezaan antara orbital hibrid dan merosot?
Perbezaan utama antara orbital hibrid dan degenerat adalah bahawa orbital hibrid adalah orbital baru yang dibentuk oleh pencampuran dua atau lebih orbital, sedangkan orbitals degenerate adalah orbital yang pada asalnya wujud dalam atom. Tambahan pula, orbital hibrid adalah orbital molekul, sementara orbital degenerat adalah orbital atom. Selain itu, orbital hibrid adalah orbital molekul yang mempunyai tenaga yang sama manakala orbital yang merosot adalah orbital atom yang mempunyai tenaga yang sama. Contohnya, SP, SP2 dan sp3 Orbital adalah orbital hibrid manakala tiga orbital p dalam p subshell.

Ringkasan -Orbital hibrid vs degenerate
Orbital hibrid adalah orbital molekul manakala orbital yang merosot adalah orbital atom. Perbezaan utama antara orbital hibrid dan degenerat adalah bahawa orbital hibrid terbentuk dengan pencampuran dua atau lebih orbital, sedangkan orbital degenerate pada asalnya wujud dalam atom.
Rujukan:
1. Helmenstine, Anne Marie. "Definisi orbit hibrid."Pemikiran, Jun. 22, 2018, boleh didapati di sini.
Ihsan gambar:
1. "SP Hibridisasi" oleh TEM5Psu - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia
2. "PX PY PZ Orbitals" oleh Yayasan CK -12 - Fail: Kimia Sekolah Tinggi.PDF, halaman 268 (CC BY-SA 3.0) melalui Commons Wikimedia


