Perbezaan antara pembelahan homolitik dan heterolitik
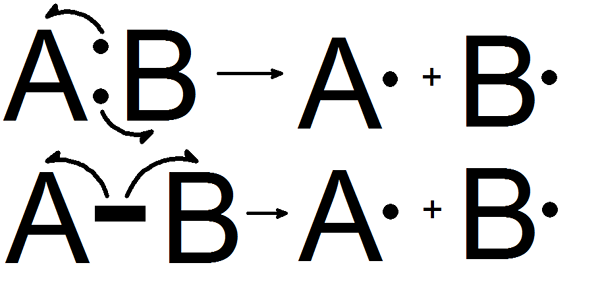
The Perbezaan utama antara pembelahan homolitik dan heterolitik ialah Pembelahan homolitik memberikan satu elektron ikatan kepada setiap serpihan sedangkan pembelahan heterolitik memberikan dua elektron ikatan kepada satu serpihan dan tidak ada elektron ikatan ke serpihan lain.
Pembelahan adalah pemusnahan ikatan kimia kovalen. Dengan kata lain, ia membahagikan satu molekul menjadi dua orang. Pembelahan datang dalam dua bentuk sebagai pembelahan homolitik yang membentuk dua moieties yang sama dan pembelahan heterolitik yang membentuk dua moieties yang tidak sama rata.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah pembelahan homolitik
3. Apakah pembelahan heterolitik
4. Perbandingan sampingan - homolytic vs pembelahan heterolitik dalam bentuk jadual
5. Ringkasan
Apakah pembelahan homolitik?
Pembelahan homolitik adalah pemisahan ikatan kimia dan membentuk dua serpihan yang sama. Ikatan kimia (ikatan kovalen) mengandungi dua elektron. Dalam bentuk pembelahan ini, setiap serpihan mendapat satu elektron yang tidak berpasangan. Apabila pemisahan ikatan ini berlaku dalam molekul neutral yang mempunyai bilangan elektron yang sama, ia membentuk dua radikal bebas yang sama.
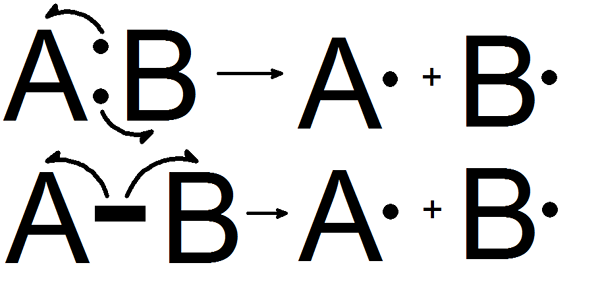
Rajah 01: Pembelahan homolitik
Tenaga pemisahan ikatan homolytic merujuk kepada tenaga yang diserap atau dibebaskan semasa proses ini. Walau bagaimanapun, pembelahan ini hanya berlaku di bawah keadaan tertentu;
- Sinaran UV
- Haba
Di samping itu, beberapa ikatan kimia tertentu seperti ikatan peroksida cukup lemah untuk memisahkan secara spontan apabila sedikit panas.
Apakah pembelahan heterolitik?
Pembelahan heterolitik adalah pemisahan ikatan kimia dan membentuk dua serpihan yang tidak sama rata. Ikatan kimia (ikatan kovalen) mengandungi dua elektron. Dalam bentuk pembelahan ini, satu serpihan mendapat kedua -dua pasangan elektron bon manakala serpihan lain tidak mendapat elektron ikatan.
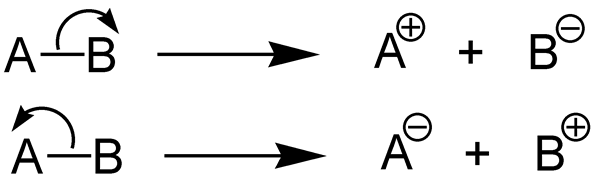
Rajah 02: Pembelahan heterolitik
Serpihan yang mendapat kedua -dua elektron bon membentuk anion. Serpihan lain membentuk kation. Di sana, serpihan yang mendapat kedua -dua elektron lebih elektronegatif daripada serpihan lain. Pembelahan ini berlaku dalam ikatan kovalen tunggal. Tenaga yang diserap atau dilepaskan semasa belahan ikatan ini dipanggil "tenaga pemisahan ikatan heterolitik".
Apakah perbezaan antara pembelahan homolitik dan heterolitik?
Pembelahan homolitik adalah pemisahan ikatan kimia dan membentuk dua serpihan yang sama. Ia memberikan satu elektron ikatan kepada setiap serpihan. Tenaga yang diserap atau dikeluarkan semasa pembelahan homolitik dipanggil "tenaga pemisahan ikatan homolytik". Pembelahan heterolitik adalah pemisahan ikatan kimia dan membentuk dua serpihan yang tidak sama rata. Ia memberikan dua elektron ikatan kepada satu serpihan dan tidak ada elektron ikatan kepada serpihan yang lain. Ini adalah perbezaan utama antara pembelahan homolitik dan heterolitik. Tenaga yang diserap atau dilepaskan semasa pembelahan heterolitik dipanggil "tenaga pemisahan ikatan heterolitik".
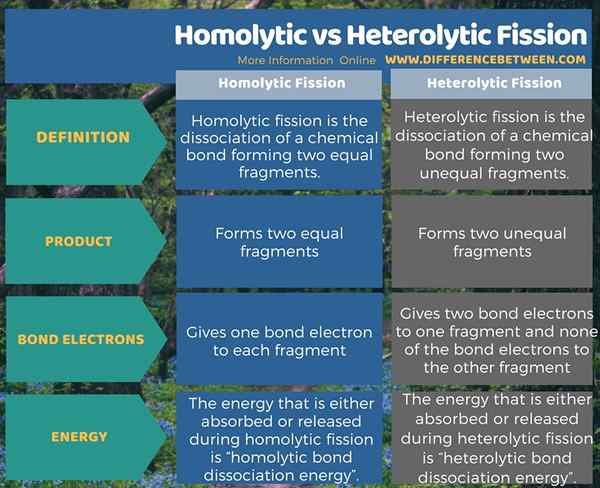
Ringkasan -Homolytic vs pembelahan heterolitik
Pembelahan adalah pemisahan bon. Ia berada dalam dua bentuk sebagai pembelahan homolitik dan heterolitik. Perbezaan antara pembelahan homolytic dan heterolytic adalah bahawa pembelahan homolitik memberikan satu elektron ikatan kepada setiap serpihan manakala pembelahan heterolitik memberikan dua elektron ikatan kepada satu serpihan dan tidak ada elektron ikatan kepada serpihan lain.
Rujukan:
1. "Homolisis (kimia)."Wikipedia, Yayasan Wikimedia, 17 Julai 2018. Terdapat di sini
2. "Pengaktif enzim."Wikipedia, Yayasan Wikimedia, 15 Julai 2018. Terdapat di sini
Ihsan gambar:
1.'Arrow menolak Homolytic'by Shoy - Kerja Sendiri, (Domain Awam) melalui Commons Wikimedia
2.'Heterolysis (Kimia)' oleh Jürgen Martens - Jürgen Martens, (CC By -SA 3.0) melalui Commons Wikimedia


