Perbezaan antara tenaga pemisahan ikatan homolitik dan heterolitik
Perbezaan utama - Homolytic vs tenaga pemisahan ikatan heterolitik
Tenaga pemisahan bon adalah ukuran kekuatan ikatan kimia. Ikatan boleh dipisahkan dengan cara homolitik atau cara heterolitik. Tenaga pemisahan bon ditakrifkan sebagai perubahan entalpi standard apabila ikatan kimia dipotong melalui homolisis. Tenaga pemisahan ikatan homolytic adalah jumlah tenaga yang diperlukan untuk memisahkan ikatan kimia melalui hemolisis manakala tenaga pemisahan ikatan heterolitik adalah jumlah tenaga yang diperlukan untuk mencengkam ikatan kimia melalui heterolisis. Nilai tenaga pemisahan ikatan homolitik berbeza daripada tenaga pemisahan ikatan heterolitik untuk sebatian yang sama. Ini adalah perbezaan utama antara tenaga pemisahan ikatan homolitik dan heterolitik.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah tenaga pemisahan ikatan homolitik
3. Apakah tenaga pemisahan ikatan heterolitik
4. Perbandingan sampingan - Homolytic vs tenaga pemisahan ikatan heterolitik dalam bentuk jadual
5. Ringkasan
Apakah tenaga pemisahan ikatan homolitik?
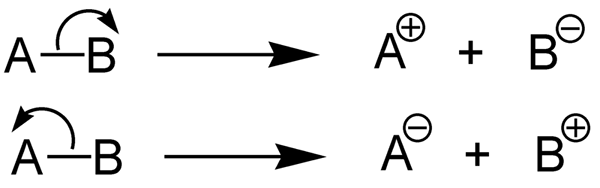
Tenaga pemisahan ikatan homolitik adalah jumlah tenaga yang diperlukan untuk memisahkan ikatan kimia melalui hemolisis. Hemolisis ikatan kimia adalah belahan simetri ikatan yang membentuk dua radikal, bukan dua ion. Di sini, elektron ikatan antara atom dibahagikan kepada dua bahagian dan diambil oleh kedua -dua atom. Contohnya, belahan homolitik ikatan sigma membentuk dua radikal yang mempunyai satu elektron yang tidak berpasangan setiap radikal.

Rajah 1: Homolisis
Tenaga pemisahan bon ditakrifkan sebagai jumlah tenaga yang diperlukan untuk memecah ikatan kimia melalui hemolisis pada keadaan standard. Tenaga pemisahan ikatan homolitik menentukan sama ada ikatan kimia kuat atau lemah. Jika nilai tenaga pemisahan ikatan homolytic lebih tinggi, ia menunjukkan bahawa jumlah tenaga yang tinggi harus disediakan untuk mengepung bon tersebut; Oleh itu, ia adalah ikatan yang kuat.
Apakah tenaga pemisahan ikatan heterolitik?
Tenaga pemisahan ikatan heterolitik adalah jumlah tenaga yang diperlukan untuk mencengkam ikatan kimia melalui heterolisis. Heterolisis adalah belahan ikatan kimia dengan cara yang tidak simetris. Heterolisis membentuk kation dan anion. Ini kerana, dalam heterolisis, pasangan elektron ikatan diambil oleh atom elektronegatif (ia ditukar menjadi anion) sedangkan atom lain tidak mengambil elektron (ia membentuk kation).

Rajah 2: Heterolisis ikatan kimia
Apabila dibandingkan dengan homolisis molekul, heterolisis molekul yang sama adalah nilai yang berbeza dari homolisis. Ini bermakna tenaga pemisahan ikatan homolitik sebatian adalah berbeza daripada tenaga pemisahan ikatan heterolitik dari molekul yang sama.
Cth: Marilah kita pertimbangkan belahan ikatan H-H dalam molekul hidrogen.
Pemisahan ikatan homolytic: h2 → H ● +H ● (Tenaga pemisahan bon adalah 104 kcal/mol)
Pemisahan ikatan heterolitik: h2 → h+ + H- (Tenaga pemisahan bon adalah 66 kcal/mol)
Apakah perbezaan antara tenaga pemisahan ikatan homolitik dan heterolitik?
Homolytic vs tenaga pemisahan ikatan heterolitik | |
| Tenaga pemisahan ikatan homolitik adalah jumlah tenaga yang diperlukan untuk memisahkan ikatan kimia melalui hemolisis. | Tenaga pemisahan ikatan heterolitik adalah jumlah tenaga yang diperlukan untuk mencengkam ikatan kimia melalui heterolisis. |
| Produk | |
| Tenaga pemisahan ikatan homolytic dikaitkan dengan pembentukan radikal oleh belahan ikatan kimia. | Tenaga pemisahan ikatan heterolitik dikaitkan dengan pembentukan kation dan anion oleh belahan ikatan kimia. |
Ringkasan -Homolytic vs Heterolytic Bond Energy Energy
Tenaga pemisahan bon adalah tenaga yang diperlukan untuk memecah ikatan kimia melalui homolisis pada keadaan standard. Terdapat dua jenis belahan ikatan sebagai homolisis dan heterolisis. Bond Homolytic Bond Cleavage membentuk radikal manakala Bond Heterolytic Bond Cleavage membentuk kation dan anion. Perbezaan utama antara tenaga pemisahan ikatan homolitik dan heterolitik ialah nilai tenaga pemisahan ikatan homolitik adalah berbeza daripada tenaga pemisahan ikatan heterolitik untuk sebatian yang sama.
Rujukan:
1. "Tenaga pembubaran bon."Wikipedia, Yayasan Wikimedia, 28 Feb. 2018, boleh didapati di sini.
2. "Heterolisis (kimia)."Wikipedia, Yayasan Wikimedia, 19 Feb. 2018, boleh didapati di sini.
3. "Tenaga pemisahan bon = belahan homolitik."RSS Kimia Organik Master, boleh didapati di sini.
Ihsan gambar:
1. "Homolisis (Kimia)" oleh Jürgen Martens - Jürgen Martens (Domain Awam) melalui Commons Wikimedia
2. "Heterolisis (Kimia)" oleh [Jürgen Martens - Jürgen Martens (CC By -SA 3.0) melalui Commons Wikimedia


