Perbezaan antara keseimbangan homogen dan heterogen
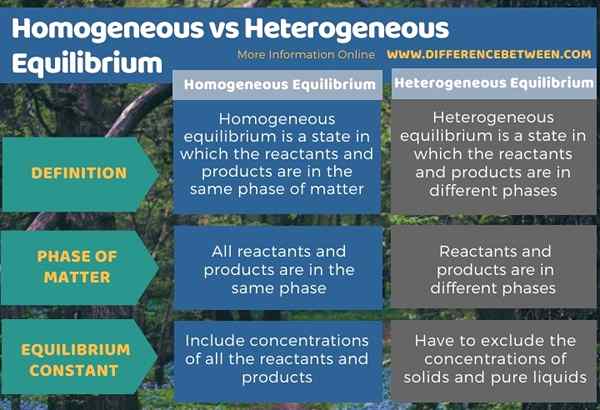
The Perbezaan utama Antara keseimbangan homogen dan heterogen ialah Dalam keseimbangan homogen, reaktan dan produk berada dalam fasa perkara yang sama sedangkan, dalam keseimbangan heterogen, reaktan dan produk berada dalam fasa yang berbeza.
Keseimbangan adalah keadaan di mana kepekatan reaktan dan produk tetap malar. Terdapat dua jenis keseimbangan sebagai keseimbangan homogen dan keseimbangan heterogen. Kedua -dua jenis ini berbeza antara satu sama lain mengikut fasa perkara reaktan dan produk dalam keseimbangan.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah keseimbangan homogen
3. Apakah keseimbangan heterogen
4. Perbandingan sampingan - homogen vs. Keseimbangan heterogen dalam bentuk jadual
5. Ringkasan
Apakah keseimbangan homogen?
Keseimbangan homogen adalah keadaan di mana reaktan dan produk berada dalam fasa yang sama. Biasanya, reaktan dan produk berada dalam satu penyelesaian. Kami memanggil campuran tindak balas jenis ini sebagai campuran homogen. Spesies kimia yang ada dalam campuran ini boleh menjadi molekul, ion, atau gabungan molekul dan ion. Tambahan pula, ungkapan untuk pemalar keseimbangan jenis tindak balas ini termasuk kepekatan semua reaktan dan produk. Sebagai contoh, mencampurkan gas sulfur dioksida dan gas oksigen memberikan gas trioksida sulfur, semua reaktan dan produk berada dalam fasa gas. Kemudian tindak balas dan keseimbangan malar (k) adalah seperti berikut:
2SO2 (g) + O2 (g) ⇌ 2SO3 (g)
K = [begitu3 (g)]2/[SO2 (g)]2[O2 (g)]

Apakah keseimbangan heterogen?
Keseimbangan heterogen adalah keadaan di mana reaktan dan produk berada dalam fasa yang berbeza. Di sana fasa boleh menjadi kombinasi fasa pepejal, cecair, dan gas. Walau bagaimanapun, tidak seperti dalam keseimbangan homogen, ketika menulis pemalar keseimbangan untuk keseimbangan heterogen, kita harus mengecualikan kepekatan pepejal dan cecair tulen. Contohnya, mencampurkan karbon dalam bentuk pepejal dengan gas oksigen memberikan gas karbon monoksida. Kemudian tindak balas dan keseimbangan malar (k) adalah seperti berikut:
O2(g) + 2c(s) ⇌ 2co(g)
K = [co(g)]2/[O2 (g)]
Apakah perbezaan antara keseimbangan homogen dan heterogen?
Keseimbangan adalah keadaan di mana kepekatan reaktan dan produk tetap malar. Terdapat dua jenis keseimbangan sebagai keseimbangan homogen dan keseimbangan heterogen. Perbezaan utama antara keseimbangan homogen dan heterogen adalah bahawa dalam keseimbangan homogen, reaktan dan produk berada dalam fasa yang sama bahan sedangkan, dalam keseimbangan heterogen, reaktan dan produk berada dalam fasa yang berbeza.
Tambahan pula, apabila menentukan pemalar keseimbangan untuk keseimbangan homogen, kita perlu memasukkan kepekatan semua reaktan dan produk; Walau bagaimanapun, apabila menentukan keseimbangan heterogen, kita perlu mengecualikan kepekatan pepejal dan cecair tulen dan perlu menggunakan kepekatan reaktan dan produk lain. Sebagai contoh, 2SO2 (g) + O2 (g) ⇌ 2SO3 (g) adalah keseimbangan homogen dan O2 (g) + 2c(s) ⇌ 2co(g) adalah contoh untuk keseimbangan heterogen.
Di bawah infographic tabulasi perbezaan antara keseimbangan homogen dan heterogen.
Ringkasan -homogen vs. Keseimbangan heterogen
Keseimbangan adalah keadaan di mana kepekatan reaktan dan produk tetap malar. Terdapat dua jenis keseimbangan sebagai keseimbangan homogen dan keseimbangan heterogen. Perbezaan utama antara keseimbangan homogen dan heterogen adalah bahawa dalam keseimbangan homogen, reaktan dan produk berada dalam fasa yang sama bahan sedangkan, dalam keseimbangan heterogen, reaktan dan produk berada dalam fasa yang berbeza. Selain itu, pemalar keseimbangan untuk keseimbangan homogen termasuk kepekatan semua reaktan dan produk, sementara pemalar keseimbangan untuk keseimbangan heterogen perlu mengecualikan kepekatan pepejal dan cecair tulen.
Rujukan:
1."Apa reaksi keseimbangan homogen dan heterogen". Kajian.com, kajian.com, boleh didapati di sini.
2."15.4: equilibria heterogen."Kimia Libretexts, Libretexts, 18 Sept. 2019, boleh didapati di sini.
3. "Homogen versus equilibria penyelesaian heterogen."Biologi Boundless. Lumen, boleh didapati di sini.
Ihsan gambar:
1. "Campuran dan Bahan Murni 2 × 2" oleh John Trombley - Kerja Sendiri (CC oleh 4.0) melalui Commons Wikimedia


