Perbezaan antara helium dan oksigen

Perbezaan utama -Helium vs oksigen
Helium dan oksigen adalah dua elemen kimia dalam jadual berkala walaupun perbezaan yang signifikan dapat dilihat di antara mereka berdasarkan sifat kimia mereka. Mereka adalah kedua -dua gas pada suhu bilik; Tetapi, helium adalah gas mulia yang tidak aktif secara kimia. Sifat kimia dari kedua -dua elemen ini sama sekali berbeza antara satu sama lain. Sebagai contoh; Oksigen cepat bertindak balas dengan banyak elemen dan sebatian, manakala Helium tidak bertindak balas dengan apa -apa. Ini dapat dikenal pasti sebagai Perbezaan utama antara helium dan oksigen. Walau bagaimanapun, tingkah laku helium lengai mempunyai begitu banyak aplikasi komersial, dan juga oksigen adalah salah satu gas yang paling tidak ternilai untuk manusia dan haiwan.
Apa itu helium?
Helium adalah Unsur kedua yang paling banyak di alam semesta, dan ia adalah elemen paling ringan kedua dalam jadual berkala. Ia adalah gas monatomik yang tidak enak, tidak berbau tidak berwarna pada suhu bilik dengan titik mendidih yang rendah. Helium adalah ahli pertama keluarga gas mulia, dan ia adalah elemen reaktif yang paling sedikit. Hanya mempunyai dua elektron yang sangat tertarik dengan nukleus. Kuantiti helium yang besar secara semulajadi dihasilkan dalam reaksi gabungan yang menghasilkan tenaga di bintang. Kerosakan radioaktif mineral juga menghasilkan helium. Di samping itu, deposit gas asli juga mengandungi gas helium.
Helium mempunyai beberapa sifat luar biasa; ia menjadi superfluid pada suhu yang sangat rendah. Superfluid boleh mengalir ke atas graviti. Helium mempunyai titik lebur terendah dari semua elemen lain. Ia adalah satu -satunya elemen yang tidak dapat dipertahankan dengan menurunkan suhu.

Apa itu oksigen?
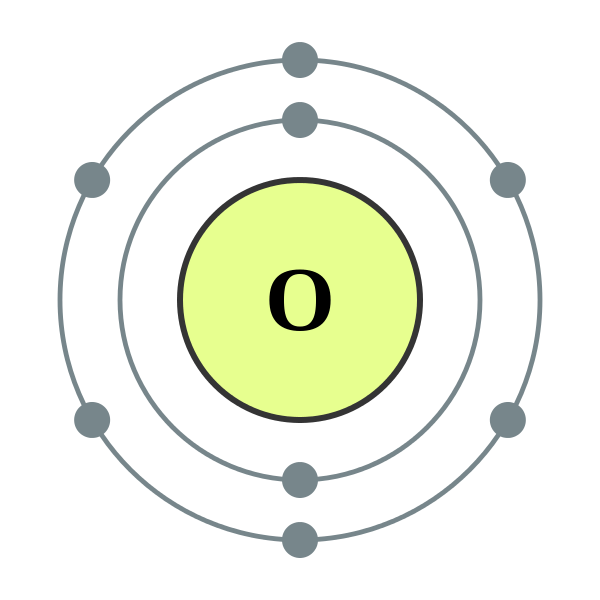
Oksigen adalah Seorang ahli kumpulan chalcogen (kumpulan VI a) dalam jadual berkalae. Ia adalah gas diatomik, sangat reaktif, tidak berwarna, tidak berbau. Oksigen adalah elemen ketiga yang paling banyak di alam semesta dengan jisim. Dalam kebanyakan tindak balas kimia; Oksigen bertindak sebagai ejen pengoksidaan, tetapi ia juga dapat mengurangkan sebatian kimia. Oksigen mempunyai dua jenis allotropes; Dioxygen (o2) dan trioxygen (o3), yang dipanggil ozon.
Apakah perbezaan antara helium dan oksigen?
Sifat helium dan oksigen:
Kereaktifan:
Helium:
Helium adalah gas lengai; ia adalah elemen reaktif paling sedikit dalam keluarga gas mulia. Dalam erti kata lain, helium benar -benar tidak aktif, ia tidak bertindak balas dengan unsur lain.
Oksigen:
Berbanding dengan helium, kereaktifan kimia oksigen sangat tinggi. Walaupun ia adalah gas stabil di-molekul pada suhu bilik, ia cepat bertindak balas dengan begitu banyak elemen dan sebatian. Walau bagaimanapun, oksigen tidak bertindak balas dengan dirinya sendiri, nitrogen, asid, pangkalan dan air dalam keadaan normal. Oksigen boleh bertindak sebagai kedua -dua ejen pengoksidaan dan pengurangan ejen; oleh itu ia menunjukkan banyak reaksi kimia. Ia mempunyai nilai elektronegativiti kedua tertinggi (bersebelahan dengan fluorin) dari unsur -unsur reaktif yang lain. Kelarutan oksigen dalam air bergantung pada suhu.
Keadaan pengoksidaan:
Helium:
Helium tidak menunjukkan pelbagai keadaan pengoksidaan. Ia hanya mempunyai satu keadaan pengoksidaan; ia adalah sifar.
Oksigen:
Keadaan oksida yang paling biasa oksigen ialah -2. Tetapi, ia mampu mempunyai keadaan pengoksidaan -2, -1, -1/2, 0, +1, dan +2.
Isotop:
Helium:
Terdapat dua jenis isotop helium yang semulajadi; Helium 3 (3Dia) dan helium 4 (4Dia). Kelimpahan relatif 3Dia sangat rendah berbanding dengan 4Dia. Tiga isotop radioaktif helium telah dibuat, tetapi mereka tidak mempunyai aplikasi komersial.
Oksigen:
Oksigen mempunyai empat isotop, tetapi hanya tiga isotop yang stabil; mereka 16O, 17O dan18O. Jenis yang paling banyak adalah 16O, yang menjadikan kira -kira 99.762%.
Aplikasi:
Helium:
Tingkah laku Helium secara kimia mempunyai banyak aplikasi. Ia digunakan dalam penyelidikan suhu rendah dalam sistem penyejukan, sebagai sumber bahan bakar dalam roket, dalam proses kimpalan, dalam sistem pengesanan plumbum, untuk mengisi belon dan untuk mencegah objek daripada bertindak balas dengan oksigen.
Oksigen:
Oksigen mempunyai banyak kegunaan dalam kehidupan seharian kita, bermula dari pernafasan; Manusia dan haiwan tidak dapat hidup tanpa oksigen. Beberapa contoh lain termasuk; Untuk menghasilkan ubat, asid, dalam pembakaran, pemurnian air, kimpalan dan logam lebur.
Gambar ihsan: 1. Elektron Shell 002 Helium - Tiada Label oleh Pumbaa (karya asal oleh Greg Robson) [CC BY -SA 2.0], melalui Wikimedia Commons 2. Elektron Shell 008 Oksigen (Diatomic Nonmetal) - Tiada label oleh Depiep (kerja sendiri) [CC BY -SA 3.0], melalui Wikimedia Commons

