Perbezaan antara halogen dan halida

The Perbezaan utama antara halogen dan halida ialah Halogen adalah unsur -unsur kimia yang mempunyai satu elektron yang tidak berpasangan di orbital P yang paling luar mereka sedangkan halida tidak mempunyai elektron yang tidak berpasangan.
Halogen adalah elemen kumpulan 7. Oleh kerana mereka mempunyai elektron yang tidak berpasangan di orbital p, keadaan pengoksidaan yang paling biasa halogen adalah -1 kerana mereka boleh stabil dengan mendapatkan satu elektron. Elektron ini mendapat halida. Oleh itu, halida adalah bentuk halogen anionik.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu halogen
3. Apa itu halida
4. Perbandingan sampingan - halogen vs halida dalam bentuk jadual
5. Ringkasan
Apa itu halogen?
Halogen adalah kumpulan 7 elemen kimia yang mempunyai 5 elektron di orbital P paling luar. Selain itu, unsur -unsur ini mempunyai satu elektron yang tidak berpasangan di orbital P. Oleh itu, sangat reaktif untuk mendapatkan elektron dari luar dan menjadi stabil. Mereka mudah membentuk bentuk anionik, halida, dengan memperoleh satu elektron.

Rajah 01: Penampilan halogen. (Dari kiri ke kanan: klorin, bromin, iodin.)
Ahli -ahli kumpulan ini adalah fluorin (F), klorin (CL), bromin (BR), iodin (i) dan astatine (AT). Selain itu, alasan untuk memberi mereka nama halogen adalah bahawa mereka semua boleh membentuk garam natrium dengan sifat yang serupa. Kita dapat melihat semua fasa perkara dalam kumpulan ini; Fluorin dan klorin bersifat gas, bromin adalah cecair dan iodin adalah sebatian pepejal di bawah keadaan normal. Astatine adalah elemen radioaktif. Selain itu, konfigurasi elektron umum unsur -unsur ini adalah ns2np5.
Apa itu halida?
Halida adalah bentuk halogen anionik. Oleh itu, spesies kimia ini membentuk apabila halogen memperoleh elektron dari luar untuk mendapatkan konfigurasi elektron yang stabil. Kemudian konfigurasi elektron menjadi ns2np6. Walau bagaimanapun, halida akan sentiasa mempunyai caj negatif. Ahli -ahli kumpulan ini termasuk Fluoride (F-), klorida (CL-), bromida (br-), iodida (i-) dan astatine (AT-). Garam yang mempunyai ion ini adalah garam halida. Tambahan pula, semua halida ini tidak berwarna dan berlaku dalam sebatian kristal pepejal. Pepejal ini mempunyai entalpi negatif yang tinggi. Oleh itu, ini bermakna pepejal ini mudah terbentuk.
Terdapat ujian khusus dari mana kita dapat mengenal pasti kehadiran halida. Sebagai contoh, kita boleh menggunakan nitrat perak untuk menunjukkan kehadiran klorida, bromida, dan iodida. Itu kerana, apabila kita menambah nitrat perak ke penyelesaian yang mengandungi ion klorida, perak klorida mendakan. Sekiranya kita menambah nitrat perak ke penyelesaian bromida, bentuk mendakan bromida perak berkrim. Untuk ion iodida yang mengandungi penyelesaian, ia memberikan endapan berwarna hijau. Tetapi, kita tidak dapat mengenal pasti fluorida dari ujian ini kerana fluorida tidak dapat membentuk precipitates dengan nitrat perak.
Apakah perbezaan antara halogen dan halida?
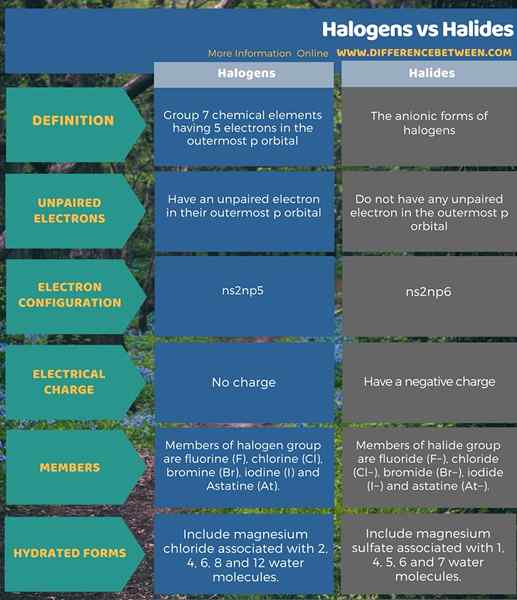
Halogen adalah kumpulan 7 elemen kimia yang mempunyai 5 elektron di orbital P paling luar, termasuk elektron yang tidak berpasangan. Halida adalah bentuk halogen anionik dan tidak mempunyai elektron yang tidak berpasangan. Ini adalah perbezaan utama antara halogen dan halida. Selanjutnya, ahli kumpulan halogen adalah fluorin (F), klorin (CL), bromin (BR), iodin (I) dan astatine (AT). Sebaliknya, ahli kumpulan halida adalah fluorida (F-), klorida (CL-), bromida (br-), iodida (i-) dan astatine (AT-). Diberikan di bawah adalah perbezaan terperinci antara halogen dan halida dalam bentuk jadual.
Ringkasan -Halogens vs Halides
Halogen adalah kumpulan 7 elemen yang mempunyai elektron yang tidak berpasangan di orbital luar. Mereka membentuk halida dengan mendapatkan elektron dan menjadi stabil. Oleh itu, perbezaan utama antara halogen dan halida adalah bahawa halogen adalah unsur -unsur kimia yang mempunyai satu elektron yang tidak berpasangan di orbital pool paling luar mereka sedangkan halida tidak mempunyai elektron yang tidak berpasangan.
Rujukan:
1. "Halide."Wikipedia, Yayasan Wikimedia, 27 Jun 2018. Terdapat di sini
2. Christe, Karl, et al. "Elemen Halogen."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 3 Nov. 2017. Terdapat di sini
Ihsan gambar:
1.'Halogens'by w. OELEN - SAINS Made Alive: Kimia, (CC BY -SA 3.0) melalui Commons Wikimedia


