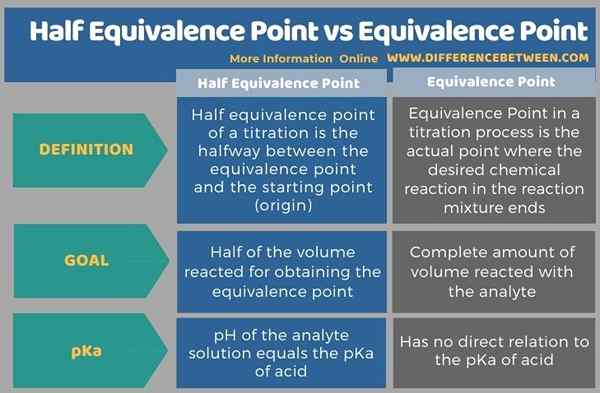
Perbezaan antara titik kesetaraan separuh dan titik kesetaraan
The Perbezaan utama Antara titik setengah titik dan titik kesetaraan ialah titik kesetaraan separuh adalah titik tengah antara titik permulaan dan titik kesetaraan titrasi tertentu manakala titik kesetaraan adalah di mana tindak balas kimia berakhir.
Titrasi adalah teknik analisis dalam kimia yang penting dalam menentukan kepekatan yang tidak diketahui sampel yang diberikan.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah titik kesetaraan
3. Apakah titik kesetaraan separuh
4. Perbandingan sampingan - setengah titik kesetaraan vs titik kesetaraan dalam bentuk jadual
5. Ringkasan
Apakah titik kesetaraan separuh?
Titik kesetaraan separuh titrasi adalah separuh antara titik kesetaraan dan titik permulaan (asal). Kepentingan perkara ini ialah pada ketika ini, pH penyelesaian analit adalah sama dengan pemisahan pemisahan atau PKA asid yang digunakan dalam titrasi. Titik kesetaraan separuh berlaku pada setengah jumlah titik kesetaraan pertama titrasi. Sekiranya terdapat beberapa titik kesetaraan dalam titrasi, terdapat beberapa titik setengah setengah yang sama dengan bilangan titik kesetaraan. Sebagai contoh, titik kesetaraan separuh kedua berlaku pada titik tengah antara titik kesetaraan pertama dan kedua.
Apakah titik kesetaraan?
Titik kesetaraan dalam titrasi adalah titik sebenar di mana tindak balas kimia yang dikehendaki dalam campuran tindak balas berakhir. Kami biasanya melakukan titrasi untuk menentukan kepekatan bahan dalam cecair. Sekiranya kita mengetahui bahan tersebut, titran (penyelesaian yang digunakan untuk menentukan kepekatan komponen dalam campuran cecair) yang mempunyai kepekatan yang diketahui dapat digunakan untuk bertindak balas dengan analit. Di sini, kami memanggil titran sebagai penyelesaian standard kerana molaritas tepatnya diketahui.

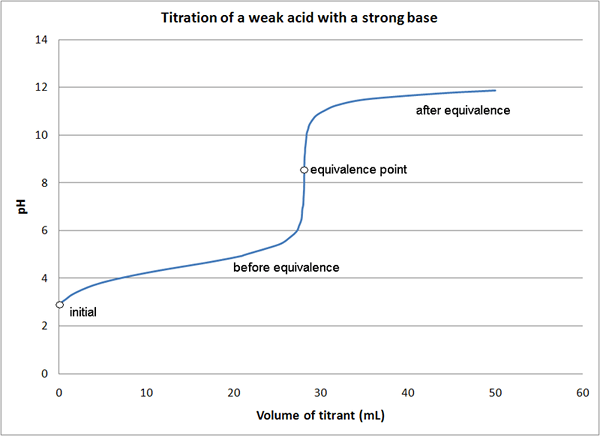
Rajah 01: Kurva titrasi yang menunjukkan titik kesetaraan
Dalam tindak balas antara NaOH dan HCl, yang merupakan tindak balas asid, kita boleh menggunakan sama ada NaOH atau HCl sebagai titran yang mempunyai kepekatan yang diketahui. Di sini, titran diletakkan di burette, dan perlahan -lahan kita dapat menambahkannya ke Titrand/Analyte sehingga perubahan warna berlaku dalam campuran reaksi. Kita perlu menggunakan penunjuk kerana NaOH dan HCl bukan penunjuk diri. Titik di mana perubahan warna berlaku adalah titik akhir titrasi, yang bukan titik kesetaraan reaksi.
Dalam titrasi ini, titik kesetaraan adalah titik di mana semua molekul HCl telah bertindak balas dengan NaOH (atau titik di mana semua molekul NaOH telah bertindak balas dengan HCl). Maka tahi lalat titran harus sama dengan tahi lalat analit yang tidak diketahui sejak stoikiometri antara HCl dan NaOH adalah 1: 1. Terdapat kaedah yang berbeza untuk menentukan titik kesetaraan titrasi.
- Perubahan warna penunjuk diri - Dalam tindak balas yang melibatkan penunjuk diri sebagai reaktan, perubahan warna mendedahkan titik kesetaraan titrasi kerana mereka tidak menggunakan petunjuk.
- Titik akhir- Kadang -kadang, titik kesetaraan dapat diambil sebagai titik akhir kerana ia lebih kurang sama.
- Konduktansi- Dalam kaedah ini, konduktansi diukur sepanjang titrasi, dan titik kesetaraan adalah di mana perubahan konduktansi pesat berlaku. Ini adalah kaedah yang agak sukar.
- Spektroskopi- Ini adalah kaedah yang sesuai untuk campuran reaksi berwarna -warni. Titik kesetaraan ditentukan mengikut perubahan pesat dalam panjang gelombang yang diserap oleh sampel.
Apakah perbezaan antara titik kesetaraan separuh dan titik kesetaraan?
Titrasi adalah teknik analisis dalam kimia yang penting dalam menentukan kepekatan yang tidak diketahui sampel yang diberikan. Perbezaan utama antara titik kesetaraan separuh dan titik kesetaraan adalah bahawa titik kesetaraan separuh adalah titik tengah antara titik permulaan dan titik kesetaraan dari titrasi tertentu manakala titik kesetaraan adalah di mana tindak balas kimia berakhir.
Di bawah tabulasi meringkaskan perbezaan antara titik kesetaraan separuh dan titik kesetaraan.
RINGKASAN -titik setengah set persamaan vs titik kesetaraan
Titrasi adalah teknik analisis dalam kimia yang penting dalam menentukan kepekatan yang tidak diketahui sampel yang diberikan. Perbezaan utama antara titik kesetaraan separuh dan titik kesetaraan adalah bahawa titik kesetaraan separuh adalah titik tengah antara titik permulaan dan titik kesetaraan dari titrasi tertentu manakala titik kesetaraan adalah di mana tindak balas kimia berakhir.
Rujukan:
1. "Titik Titrasi & Titik Kesetaraan (Artikel)." Akademi Khan, Terdapat di sini.
Ihsan gambar:
1. "Titrasi Asid Lemah dengan Asas Kuat" oleh QuantumKinetics - Kerja Sendiri (CC oleh 3.0) melalui Commons Wikimedia


