Perbezaan antara H2S dan SO2
The Perbezaan utama antara H2S dan SO2 ialah H2S mempunyai bau telur busuk, sedangkan So2 mempunyai bau perlawanan yang dibakar.
Kedua -dua H2S dan SO2 adalah sebatian gas pada suhu bilik. Sebatian ini mengandungi atom belerang. H2S adalah hidrida sulfur manakala SO2 adalah oksida sulfur. Selain itu, kedua -dua gas ini mempunyai bau pedas.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu H2S
3. Apa itu SO2
4. Perbandingan sampingan -H2S vs SO2 dalam bentuk jadual
5. Ringkasan
Apa itu H2S?
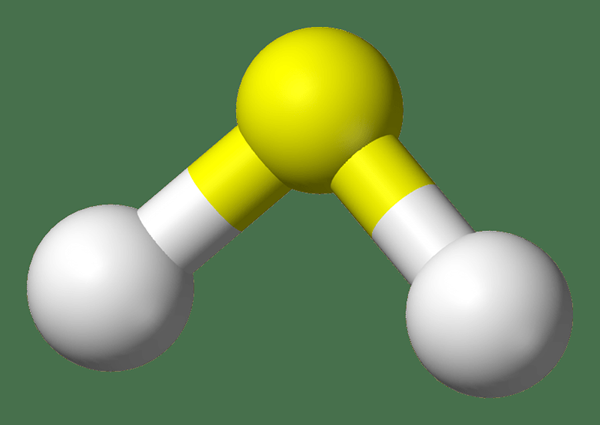
H2S adalah hidrogen sulfida. Ia adalah gas pada suhu bilik, mempunyai bau telur busuk. Oleh itu, ia mempunyai bau yang pedas dan menjengkelkan. Gas ini sangat beracun. Selain itu, ia adalah menghakis dan mudah terbakar. Oleh itu, kita perlu mengatasinya dengan teliti. Jisim molar H2S adalah 38.09 g/mol. Nampaknya gas tidak berwarna.
Gas H2S sedikit lebih padat daripada udara atmosfera biasa. Walau bagaimanapun, campuran udara dan H2 boleh menyebabkan reaksi letupan. Selain itu, gas ini terbakar di udara dengan api biru apabila kehadiran gas oksigen. Reaksi ini memberikan SO2 dan air. Umumnya, gas H2S bertindak sebagai ejen pengurangan kerana ia hanya dapat menjalani pengoksidaan kerana atom sulfur dalam sebatian ini berada dalam keadaan pengoksidaan paling sedikit (tidak dapat dikurangkan lagi).

Rajah 01: Struktur gas H2S
Kita boleh menggunakan H2S untuk mendapatkan sulfur elemental. Reaksi antara H2S dan SO2 dengan kehadiran pemangkin dan suhu tinggi memberikan sulfur unsur dan air. Ini adalah kaedah penting untuk melupuskan H2S. Selain itu, H2S sedikit larut air dan apabila pembubaran, ia boleh membentuk asid lemah.
H2S boleh bertindak balas dengan logam dan membentuk sulfida logam. Sulfida logam ini adalah sebatian yang tidak larut air yang mempunyai warna gelap. Contohnya, kita boleh menggunakan kertas yang digunakan oleh asetat (ii) untuk mengesan H2S yang berkembang dari sampel kerana plumbum di dalam kertas boleh bertindak balas dengan H2S membentuk warna hitam sulfida hitam.
Apa itu SO2?
So2 adalah sulfur dioksida. Ia adalah gas toksik yang tidak berwarna dan mempunyai bau perlawanan terbakar. Secara semula jadi, gas ini berkembang dari letusan gunung berapi. Jisim molar gas ini adalah 64.8 g/mol. Ia sedikit larut air dan apabila pembubaran, ia membentuk asid sulfur. Selain itu, gas ini boleh menjalani tindak balas pengoksidaan dan pengurangan kerana atom sulfur dalam molekul ini berada di antara sekurang -kurangnya dan pengoksidaan tertinggi menyatakan bahawa atom sulfur dapat menunjukkan. Oleh itu, SO2 boleh bertindak sebagai ejen pengurangan dan sebagai ejen pengoksidaan.
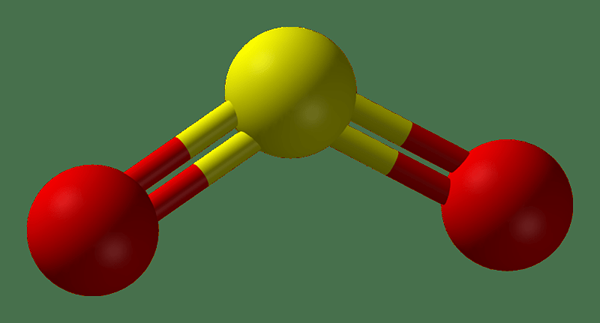
Rajah 02: Struktur gas SO2
Apabila mempertimbangkan pengeluaran SO2, ia terutamanya dihasilkan daripada pembuatan asid sulfurik. Selain itu, gas SO2 adalah produk sulfur yang terbakar (atau bahan pembakaran yang mengandungi belerang). Di samping itu, gas ini adalah hasil sampingan pembuatan simen silikat kalsium. Kita boleh menghasilkan SO2 dari reaksi asas berair dengan SO2.
Apakah perbezaan antara H2S dan SO2?
Kedua -dua H2S dan SO2 adalah sebatian gas pada suhu bilik. Perbezaan utama antara H2S dan SO2 ialah H2S mempunyai bau telur busuk, sedangkan SO2 mempunyai bau perlawanan yang dibakar. Oleh itu, kedua -dua gas ini mempunyai bau pedas. Selain itu, kita dapat menghasilkan H2 melalui pemisahan gas masam sementara kita dapat menghasilkan SO2 sebagai hasil sampingan dari pembuatan asid sulfurik.
Apabila mempertimbangkan penggunaan gas ini, kita boleh menggunakan H2S untuk pengeluaran sulfur elemen, dalam analisis kualitatif logam, sebagai pendahulu kepada sulfida logam, dan lain -lain., sedangkan SO2 berguna sebagai pendahulu untuk asid sulfurik, sebagai bahan tambahan makanan, sebagai ejen pengurangan, dalam winemaking, dll.
Di bawah infographic meringkaskan perbezaan antara H2S dan SO2.
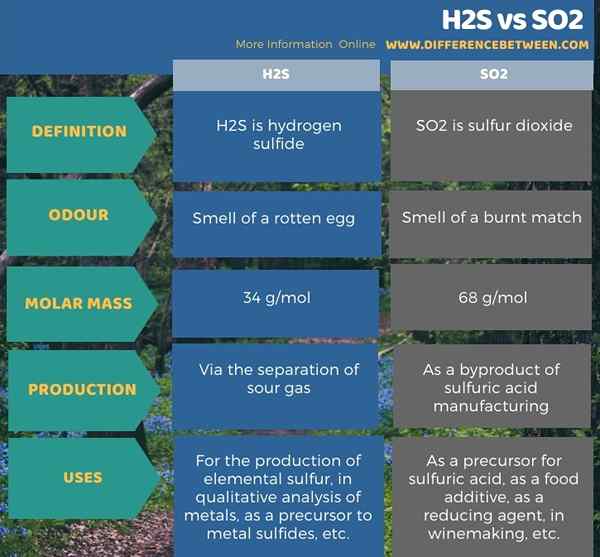
Ringkasan -H2S vs SO2
Kedua -dua H2S dan SO2 adalah sebatian gas pada suhu bilik. Perbezaan utama antara H2S dan SO2 ialah H2S mempunyai bau telur busuk, sedangkan SO2 mempunyai bau perlawanan yang dibakar.
Rujukan:
1. Helmenstine, Anne Marie, "10 Fakta Sulfur Menarik."Thoughtco, Oct. 8, 2019, boleh didapati di sini.
Ihsan gambar:
1. "Hydrogen-sulfide-3D-Balls" oleh Ben Mills-Kerja Sendiri (Domain Awam) melalui Commons Wikimedia
2. "Sulfur-Dioxide-3D-Balls" oleh Ben Mills-Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


