Perbezaan antara radikal dan ion percuma
The Perbezaan utama antara radikal bebas dan ion ialah Radikal bebas mempunyai satu atau lebih elektron yang tidak berpasangan, tetapi ion mempunyai elektron berpasangan.
Kita dapat menjelaskan perbezaan antara radikal dan ion bebas dari sifat asas ion dan radikal bebas. Ion boleh berlaku sebagai molekul atau atom dengan caj (positif atau negatif) disebabkan oleh kehilangan atau keuntungan elektron. Ion memegang caj negatif kerana keuntungan elektron dan memegang caj positif kerana kehilangan elektron. Ion mungkin berlaku sebagai spesies kimia tunggal atau pelbagai, bergantung kepada bilangan elektron yang diperoleh atau hilang. Radikal bebas adalah molekul atau atom yang mempunyai sekurang -kurangnya satu elektron yang tidak berpasangan. Artikel ini adalah mengenai perbezaan antara radikal dan ion bebas, termasuk ciri khas mereka.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu radikal percuma
3. Apa itu ion
4. Perbandingan sampingan - ion radikal percuma dalam bentuk jadual
5. Ringkasan
Apa itu radikal percuma?
Radikal bebas adalah atom atau sekumpulan atom yang mengandungi satu atau lebih elektron yang tidak berpasangan. Mereka sangat reaktif kerana kehadiran elektron yang tidak berpasangan. Radikal bebas sangat tidak stabil dan cuba mendapatkan kestabilan dengan menerima elektron yang diperlukan. Mereka bertindak balas dengan sebatian kimia lain dengan menangkap elektron yang diperlukan. Radikal bebas adalah perantaraan penting dalam proses semula jadi. Kita boleh menandakan radikal bebas dengan titik superskrip di sebelah kanan. Contohnya, h., Cl., Ho., H3C.
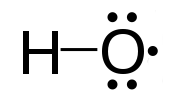
Rajah 01: Radikal hidroksil
Radikal bebas yang lama berada dalam tiga kategori: radikal stabil, radikal berterusan, dan di-radikal.
- Radikal yang stabil: Contoh utama radikal yang stabil ialah oksigen molekul o2. Radikal organik yang mengandungi sistem π konjugasi mungkin lama hidup.
- Radikal berterusan: Mereka sudah lama bertahan kerana berkerumun sterik di sekitar pusat radikal dan menjadikannya sukar untuk bertindak balas dengan molekul lain.
- Di-radikal: Beberapa molekul mempunyai dua pusat radikal, kami namakannya sebagai di-radikal. Oksigen molekul secara semulajadi (oksigen atmosfera) wujud sebagai diradikal.
Apa itu ion?
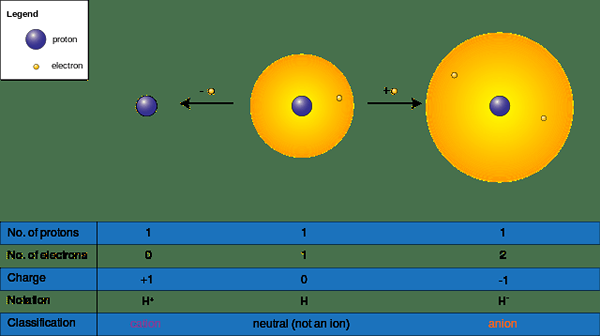
Ion boleh terbentuk apabila spesies kimia memperoleh atau kehilangan elektron dalam tindak balas kimia; mereka mempunyai caj positif (+) atau negatif (-). Mereka mendapat caj negatif dengan menerima elektron dan caj positif dengan menderma elektron ke molekul kekurangan elektron atau elemen. Menerima atau menderma elektron secara langsung mempengaruhi saiz ion; ia mengubah saiz molekul secara dramatik. Kami menamakan atom atau sekumpulan atom tanpa caj negatif atau positif sebagai "neutral"; Untuk menjadi atom neutral atau molekul, bilangan proton perlu sama dengan sebilangan elektron.
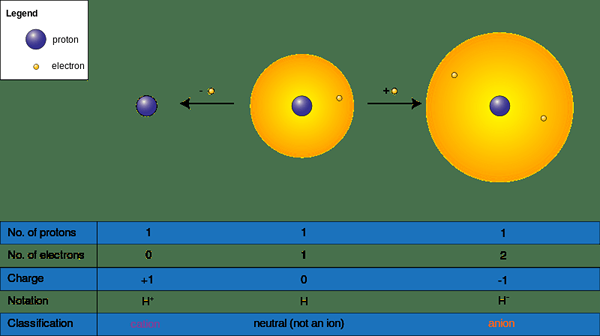
Rajah 02: Pembentukan kation dan anion
Oleh itu terdapat dua bentuk ion seperti berikut.
- Kation atau (+) ion - Selalunya logam datang di bawah kategori ini kerana logam kehilangan elektron menjadi positif (+) dikenakan (NA+, Ba2+, Ca2+, Al3+)
- Ion anion (-) - Selalunya bukan metals berada di bawah kategori ini kerana bukan logam mendapat elektron menjadi negatif (-) dikenakan (cl-, S2-, O2-, Br-)
Apakah perbezaan antara radikal dan ion bebas?
Perbezaan utama antara radikal dan ion bebas ialah radikal bebas mempunyai satu atau lebih elektron yang tidak berpasangan, tetapi ion mempunyai elektron berpasangan. Oleh itu, radikal bebas sangat tidak stabil sementara ion agak stabil. Oleh itu, ini juga merupakan perbezaan yang signifikan antara radikal dan ion bebas. Walau bagaimanapun, radikal boleh wujud dengan sendirinya sementara kebanyakan ion digabungkan dengan ion yang bertentangan. Apabila mempertimbangkan lebih lanjut mengenai kestabilan mereka, radikal bebas menjadi stabil dengan menerima elektron, tetapi ion stabil apabila mereka membentuk kompleks dengan sebatian yang bertentangan.
Satu lagi perbezaan penting antara radikal bebas dan ion ialah ion -ion sentiasa memegang caj, tetapi radikal bebas tidak dikenakan spesies walaupun mereka mempunyai elektron yang tidak berpasangan. Perbezaan ini timbul kerana, dalam ion, jumlah elektron selalu tidak sama dengan bilangan proton dalam nukleus semasa dalam radikal bebas, bilangan elektron adalah sama dengan bilangan proton.
Infographic di bawah memberikan maklumat lanjut mengenai perbezaan antara radikal dan ion percuma.
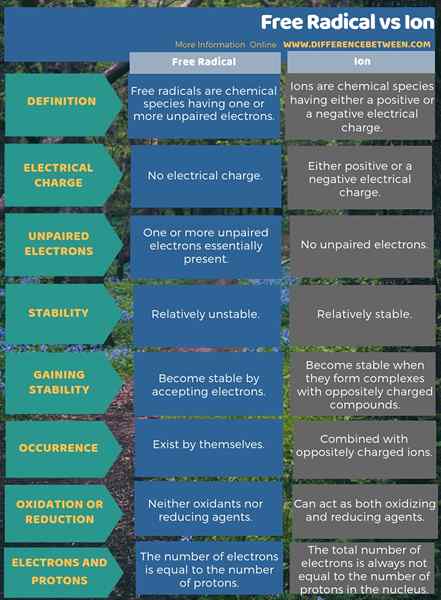
Ringkasan -ion radikal percuma
Kita dapat menerangkan kedua -dua istilah, radikal dan ion bebas, menggunakan bilangan elektron yang dimiliki oleh spesies tertentu. Di sini, perbezaan yang paling ketara antara radikal dan ion bebas adalah bahawa radikal bebas mempunyai elektron yang tidak berpasangan tetapi, ion telah berpasangan elektron. Oleh itu, radikal bebas lebih reaktif. Sebaliknya, ion menjadi stabil secara kimia dengan membentuk sebatian dengan ion/molekul yang bertentangan.
Rujukan:
1. "Radikal (Kimia)."Wikipedia, Yayasan Wikimedia, 8 Okt. 2018. Terdapat di sini
2. "Ion."Wikipedia, Yayasan Wikimedia, 16 Okt. 2018. Terdapat di sini
Ihsan gambar:
1."Radikal Hidroksil" oleh Smokeyjoe - Kerja Sendiri, (CC BY -SA 4.0) melalui Commons Wikimedia
2."Ion" oleh JKWCHUI - Kerja Sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia


