Perbezaan antara penyejatan dan pengewapan

The Perbezaan utama antara penyejatan dan pengewapan adalah Penyejatan cecair berlaku pada suhu yang berada di bawah titik mendidih cecair itu, sedangkan pengewapan berlaku pada titik mendidih cecair.
Kedua -dua penyejatan dan pengewapan merujuk kepada proses di mana cecair berubah menjadi fasa gasnya. Walaupun penyejatan berlaku hanya dalam cecair, pengewapan boleh berlaku dalam pepejal juga; Kami memanggil sublimasi ini (penukaran fasa pepejal terus ke fasa gas tanpa melalui fasa cecair).
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu penyejatan
3. Apa itu pengewapan
4. Perbandingan sampingan - penyejatan vs pengewapan dalam bentuk jadual
5. Ringkasan
Apa itu penyejatan?
Penyejatan adalah penukaran cecair ke fasa gasnya pada suhu yang berada di bawah titik mendidih cecair. Molekul dalam cecair mempunyai tenaga kinetik yang berbeza. Apabila kita memberikan tenaga dari luar ke cecair (seperti haba), tenaga kinetik molekul cecair ini meningkat. Apabila tenaga sudah cukup untuk molekul di permukaan untuk mengatasi daya intermolecular di antara mereka, molekul cenderung melarikan diri dari permukaan dan ditukar menjadi keadaan gas.

Rajah 01: Penyejatan berlaku di permukaan air
Walau bagaimanapun, beberapa molekul yang memasuki fasa gas melalui penyejatan dapat bergabung semula dengan cecair melalui pemeluwapan. Ini membentuk keseimbangan antara kadar penyejatan dan kadar pemeluwapan. Selain itu, tekanan wap berterusan ditubuhkan pada tahap ini. Sekiranya kita meningkatkan suhu cecair pada titik ini, ia membawa kepada peningkatan kadar penyejatan sejak tenaga kinetik molekul meningkat. Oleh itu, jumlah molekul yang menduduki ruang di atas cecair meningkat.
Apa itu pengewapan?
Pengewapan adalah penukaran fasa cecair ke fasa gas di titik mendidih cecair. Oleh itu, pengewapan berlaku pada suhu mendidih cecair.

Rajah 02: Air mendidih
Untuk mendidih cecair, tekanan wap cecair harus sama dengan tekanan luaran yang mengelilingi cecair. Ini bermakna molekul di permukaan cecair harus mempunyai tenaga kinetik yang mencukupi untuk mengatasi daya intermolecular antara molekul cecair; Oleh itu, molekul -molekul ini boleh meninggalkan cecair dengan menukar ke fasa gas.
Apakah perbezaan antara penyejatan dan pengewapan?
Penyejatan dan pengewapan adalah proses di mana bahan cecair ditukar menjadi fasa gasnya. Perbezaan utama antara penyejatan dan pengewapan ialah penyejatan cecair berlaku pada suhu yang berada di bawah titik mendidih cecair itu, sedangkan pengewapan berlaku pada titik mendidih cecair. Selain itu, penyejatan berlaku apabila tekanan wap cecair lebih rendah daripada tekanan luaran yang mengelilingi cecair semasa pengewapan berlaku apabila tekanan wap cecair adalah sama dengan tekanan luaran.
Tambahan pula, semasa penyejatan, molekul di permukaan cecair cuti terlebih dahulu manakala pengewapan boleh berlaku di mana -mana lokasi cecair (itulah sebabnya kita dapat melihat menggelegak air di bahagian bawah bekas ketika memanaskannya).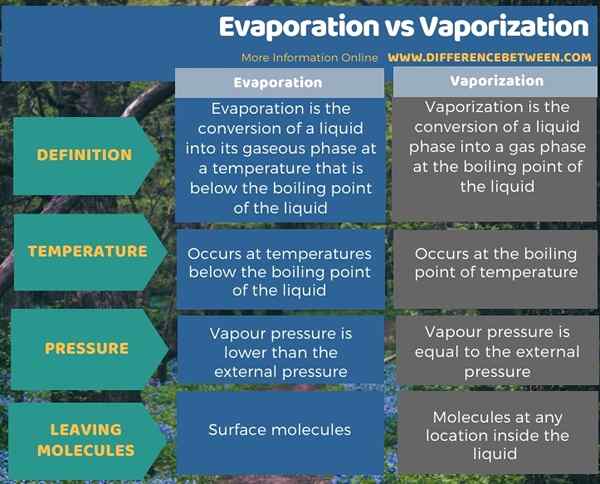
Ringkasan -Penyejatan vs pengewapan
Kedua -dua penyejatan dan pengewapan merujuk kepada proses di mana bahan cecair berubah menjadi fasa gasnya. Perbezaan utama antara penyejatan dan pengewapan ialah penyejatan cecair berlaku pada suhu yang berada di bawah titik mendidih cecair itu, sedangkan pengewapan berlaku pada titik mendidih cecair.
Rujukan:
1. Helmenstine, Todd. "Panas masalah pengewapan masalah."Thoughtco, Jan. 29, 2020, boleh didapati di sini.
2. Helmenstine, Anne Marie. "Definisi penyejatan dalam kimia."Thoughtco, Jan. 29, 2020, boleh didapati di sini.
Ihsan gambar:
1. "Pengewapan" oleh Tristan Schmurr (CC oleh 2.0) melalui Flickr
2. "Air mendidih di kuali" oleh Appliance City (CC oleh 2.0) melalui Flickr


