Perbezaan antara titik kesetaraan dan titik akhir
The Perbezaan utama antara titik kesetaraan dan titik akhir ialah Titik kesetaraan dalam titrasi adalah titik di mana titran tambahan bersamaan dengan kimia sepenuhnya dengan analit dalam sampel sedangkan titik akhir adalah titik di mana penunjuk mengubah warnanya.
Titrasi adalah teknik yang kita gunakan secara meluas dalam kimia analisis untuk menentukan asid, pangkalan, oksidan, reductants, ion logam dan banyak spesies lain. Dalam titrasi, tindak balas kimia berlaku. Di sini, analisis bertindak balas dengan reagen standard, yang kita panggil sebagai titran. Kadang -kadang kita menggunakan standard utama, yang merupakan penyelesaian yang sangat disucikan dan stabil, sebagai bahan rujukan dalam kaedah titrimetrik. Kami menggunakan penunjuk untuk mengesan titik akhir reaksi. Tetapi, bukan titik sebenar di mana tindak balas kimia berakhir. Titik sebenar adalah titik kesetaraan.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu titik akhir
3. Apakah titik kesetaraan
4. Perbandingan sampingan - titik kesetaraan vs titik akhir dalam bentuk jadual
5. Ringkasan
Apa itu titik akhir?
Dalam mana -mana titrasi, titik akhir adalah titik di mana penunjuk mengubah warna. Atau sebaliknya kita boleh menggunakan perubahan dalam tindak balas instrumental untuk mengenal pasti titik akhir. Contohnya, HCL dan NaOH bertindak balas 1: 1 dan menghasilkan NaCl dan air. Untuk titrasi ini, kita boleh menggunakan penunjuk phenolphthalein, yang mempunyai warna merah jambu dalam medium asas dan bertukar menjadi tidak berwarna dalam medium berasid. Sekiranya kita meletakkan HCl dalam botol titrasi dan itu, jika kita menambah setitik phenolphthalein, ia menjadi tidak berwarna.

Rajah 02: Titik akhir adalah titik perubahan warna
Semasa titrasi, kita boleh menambah NaOH dari burette dan secara beransur -ansur, HCL dan NaOH akan bertindak balas dalam kelalang. Sekiranya kita mengambil kepekatan yang sama dari kedua -dua penyelesaian, apabila kita menambah jumlah NaOH yang sama ke dalam botol, penyelesaian dalam kelalang akan beralih kepada warna merah jambu cahaya. Ini adalah titik di mana kita menghentikan titrasi (titik akhir). Kami menganggap, pada ketika ini, tindak balas selesai.
Apakah titik kesetaraan?
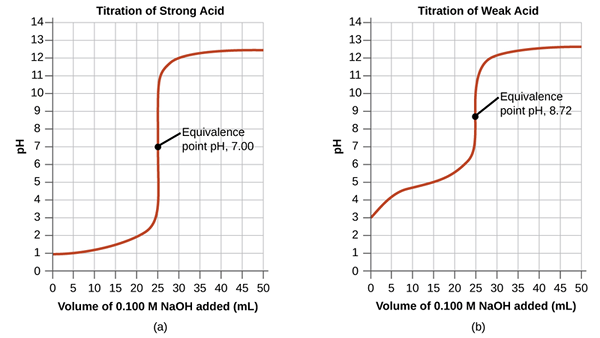
Titik kesetaraan dalam titrasi adalah titik di mana titran tambahan bersamaan dengan kimia sepenuhnya dengan analit dalam sampel. Ini adalah titik di mana tindak balas kimia melengkapkan secara stoikiometrik.

Rajah 01: Titik kesetaraan untuk asid kuat dan titrasi asid lemah
Walaupun kita menentukan titik akhir dari perubahan warna penunjuk, kebanyakan masa, bukan titik akhir sebenar reaksi. tindak balas selesai sedikit sebelum titik itu. Pada titik kesetaraan ini, medium adalah neutral. Dalam contoh yang dibincangkan di bahagian sebelumnya, selepas menambah penurunan NaOH tambahan, medium akan menunjukkan warna asas phenolphthalein, yang kami ambil sebagai titik akhir.
Apakah perbezaan antara titik kesetaraan dan titik akhir?
Titik kesetaraan dalam titrasi adalah titik di mana titran tambahan bersamaan dengan kimia sepenuhnya dengan analit dalam sampel sedangkan titik akhir adalah titik di mana penunjuk mengubah warnanya. Ini adalah perbezaan utama antara titik kesetaraan dan titik akhir. Selain itu, titik kesetaraan selalu datang sebelum titik akhir titrasi.

Ringkasan - titik kesetaraan vs titik akhir
Dalam mana -mana titrasi, kami mempunyai dua perkara penting; iaitu titik setara dan titik akhir titrasi. Perbezaan utama antara titik kesetaraan dan titik akhir adalah bahawa titik kesetaraan dalam titrasi adalah titik di mana titran ditambah bersamaan dengan kimia sepenuhnya kepada analit dalam sampel sedangkan titik akhir adalah titik di mana penunjuk mengubah warnanya.
Rujukan:
1. "Titik Kesetaraan."Wikipedia, Yayasan Wikimedia, 15 Apr. 2018. Terdapat di sini
2. Libretexts. "Fundamental titrasi."Kimia Libretexts, Libretexts, 21 Julai 2016. Terdapat di sini
Ihsan gambar:
1."CNX Chem 14 07 Titration" oleh OpenStax (CC oleh 4.0) melalui Commons Wikimedia
2."Phenolphthalein dalam Flask" oleh 384 - Kerja Sendiri, (CC BY -SA 4.0) melalui Commons Wikimedia


