Perbezaan antara pemalar keseimbangan dan pembentukan tetap
The Perbezaan utama antara pemalar keseimbangan dan pemalar pembentukan ialah Pemalar keseimbangan adalah nisbah antara kepekatan produk dan kepekatan reaktan pada keseimbangan manakala pemalar pembentukan adalah pemalar keseimbangan untuk pembentukan sebatian koordinasi dari komponennya.
Pemalar keseimbangan berguna dalam menjelaskan tingkah laku keadaan keseimbangan yang berbeza. Pemalar pembentukan adalah sejenis pemalar keseimbangan yang khusus untuk pembentukan sebatian koordinasi; Contohnya, ion kompleks.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah keseimbangan keseimbangan
3. Apakah pembentukan tetap
4. Perbandingan sampingan - Keseimbangan tetap vs pembentukan pemalar dalam bentuk jadual
5. Ringkasan
Apakah keseimbangan keseimbangan?
Pemalar keseimbangan adalah nisbah antara kepekatan produk dan kepekatan reaktan pada keseimbangan. Istilah ini hanya digunakan dengan reaksi yang ada dalam keseimbangan. Reaksi reaksi dan pemalar keseimbangan adalah sama untuk reaksi yang ada dalam keseimbangan.
Pemalar keseimbangan juga diberikan sebagai kepekatan yang dibangkitkan kepada kuasa pekali stoikiometrik. Pemalar keseimbangan bergantung kepada suhu sistem yang dipertimbangkan sejak suhu mempengaruhi kelarutan komponen dan pengembangan kelantangan. Walau bagaimanapun, persamaan pemalar keseimbangan tidak termasuk sebarang butiran mengenai pepejal yang antara reaktan atau produk. Hanya bahan dalam fasa cecair dan fasa gas yang dipertimbangkan.
Sebagai contoh, mari kita pertimbangkan keseimbangan antara asid karbonik dan ion bikarbonat.
H2Co3 (aq) ↔ HCO3- (aq) + H+ (aq)
Pemalar keseimbangan untuk tindak balas di atas diberikan seperti di bawah.
Pemalar keseimbangan (k) = [HCO3- (aq)] [H+ (aq)] / [H2Co3 (aq)]

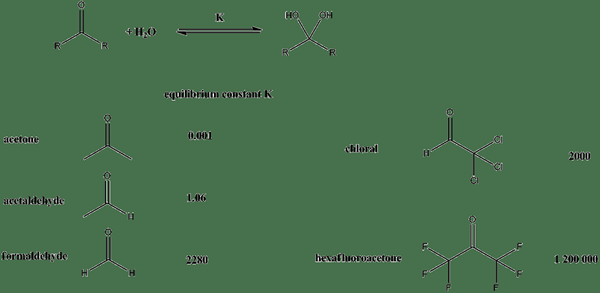
Rajah 01: Pemalar keseimbangan untuk sebatian yang berbeza apabila mereka berada dalam penyelesaian berair
Apakah pembentukan tetap?
Pemalar pembentukan adalah pemalar keseimbangan untuk pembentukan kompleks koordinat dari komponennya dalam penyelesaian. Kita boleh menunjukkannya sebagai kf. Keseimbangan ini digunakan terutamanya untuk pembentukan ion kompleks. Komponen yang kita perlukan untuk pembentukan ion kompleks adalah ion logam dan ligan.
Bentuk ion kompleks hasil daripada interaksi asid-asas Lewis ion logam dan ligan. Ion logam selalu membawa caj positif dan ia bertindak sebagai asid Lewis manakala ligan harus membawa satu atau lebih pasangan elektron tunggal untuk bertindak sebagai pangkalan Lewis. Ion logam kecil mempunyai kecenderungan yang hebat untuk membentuk ion kompleks kerana mereka mempunyai ketumpatan cas tinggi.
Umumnya, pembentukan ion kompleks adalah tindak balas langkah demi langkah yang merangkumi semua langkah yang terlibat dalam penambahan ligan satu demi satu; Oleh itu, langkah -langkah ini mempunyai pemalar keseimbangan individu juga. Sebagai contoh, pembentukan ion kompleks tembaga-amonium mempunyai empat langkah. Oleh itu ia mempunyai empat nilai malar keseimbangan yang berbeza: K1, K2, K3 dan K4. Kemudian, pembentukan pemalar untuk tindak balas keseluruhan adalah seperti berikut:
Kf = K1K2K3K4
Apakah perbezaan antara pemalar keseimbangan dan pemalar pembentukan?
Pemalar keseimbangan berguna dalam menjelaskan tingkah laku keadaan keseimbangan yang berlainan, sementara pemalar pembentukan adalah sejenis keseimbangan keseimbangan. Perbezaan utama antara pemalar keseimbangan dan pemalar pembentukan adalah bahawa pemalar keseimbangan adalah nisbah antara kepekatan produk dan kepekatan reaktan pada keseimbangan, sedangkan pemalar pembentukan adalah pemalar keseimbangan untuk pembentukan sebatian koordinasi dari komponennya.
Di bawah infographic meringkaskan perbezaan antara pemalar keseimbangan dan pembentukan tetap.
Ringkasan -Keseimbangan berterusan vs pembentukan tetap
Pemalar keseimbangan berguna dalam menjelaskan tingkah laku keadaan keseimbangan yang berbeza manakala pemalar pembentukan adalah jenis keseimbangan keseimbangan. Perbezaan utama antara pemalar keseimbangan dan pemalar pembentukan adalah bahawa pemalar keseimbangan adalah nisbah antara kepekatan produk dan kepekatan reaktan pada keseimbangan, sedangkan pemalar pembentukan adalah pemalar keseimbangan untuk pembentukan sebatian koordinasi dari komponennya.
Rujukan:
1. "17.3: Pembentukan ion kompleks."Kimia Libretexts, Libretexts, 17 Jun 2019, boleh didapati di sini.
Ihsan gambar:
1. "Hidrasi" oleh Nikolaivica - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia


