Perbezaan antara penyamaan dan peneutralan
The Perbezaan utama antara penyamaan dan peneutralan ialah Penyamaan merujuk kepada mengimbangi atom persamaan tindak balas kimia, sedangkan peneutralan adalah mengimbangi keasidan atau asas untuk mendapatkan penyelesaian neutral.
Walaupun istilah penyamaan dan peneutralan bunyi serupa, mereka berbeza antara satu sama lain dalam makna dan aplikasi. Walau bagaimanapun, kedua -dua istilah ini merujuk kepada proses pengimbangan komponen kimia.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu penyamaan
3. Apa itu peneutralan
4. Perbandingan sampingan -penyamaan vs peneutralan dalam bentuk jadual
5. Ringkasan
Apa itu penyamaan?
Penyamaan adalah teknik mengimbangi atom persamaan tindak balas kimia. Di sini, kita harus menyamakan bilangan atom di sisi reaktan kepada bilangan atom di bahagian produk. Ini bermakna atomisiti sebelum dan selepas tindak balas kimia harus sama. Untuk tujuan ini, kita boleh menggunakan pekali stoikiometrik di hadapan reaktan dan produk (pekali stoikiometrik adalah nombor yang muncul sebelum simbol spesies kimia dalam persamaan untuk reaksi kimia. Nilai -nilai ini adalah nilai Unitless).
Langkah -langkah berikut membantu kita mengimbangi persamaan kimia untuk tindak balas kimia yang mudah.
- Tuliskan persamaan yang tidak seimbang. (E.g. C3H8 + O2 ⟶ co2 + H2O)
- Tentukan bilangan setiap atom yang terdapat di bahagian reaktan dan bahagian produk. (Di sisi reaktan terdapat 8 atom hidrogen, 3 atom karbon dan 2 atom oksigen. Di sisi produk, terdapat 2 atom hidrogen, 3 atom oksigen dan satu atom karbon).
- Simpan atom hidrogen dan oksigen untuk terakhir.
- Gunakan pekali stoikiometrik untuk mengimbangi elemen tunggal. (Gunakan pekali stoikiometrik "3" di hadapan CO2) e.g. C3H8 + O2 ⟶ 3Co2 + H2O
- Seimbang bilangan atom hidrogen. (Terdapat 8 atom hidrogen di sisi reaktan tetapi hanya 2 di sisi produk, jadi, kita harus menggunakan pekali stoikiometrik 4 di hadapan h2O) e.g. C3H8 + O2 ⟶ 3co2 + 4H2O
- Seimbang bilangan atom oksigen. E.g. C3H8 + 5O2 ⟶ 3co2 + 4H2O
Apa itu peneutralan?
Reaksi peneutralan adalah tindak balas kimia antara asid dan asas, yang menghasilkan larutan neutral. Penyelesaian neutral akan sentiasa mempunyai pH 7. Reaksi ini melibatkan gabungan ion H+dan OH-ion untuk membentuk molekul air.
Jika pH akhir campuran asid dan asas reaksi adalah 7, ini bermakna jumlah yang sama H+dan OH-ion telah bertindak balas di sini (untuk membentuk molekul air, satu h+ion dan satu oh diperlukan). Asid dan asas yang bertindak balas boleh menjadi kuat atau lemah. Reaksi berbeza -beza bergantung pada fakta ini.

Rajah 01: Titrasi peneutralan asas asid kuat yang kuat
Terdapat empat jenis tindak balas peneutralan yang berbeza: tindak balas asas asid kuat, tindak balas asas asid-weak yang kuat, tindak balas asas asid yang lemah, dan reaksi asas asid-weak yang lemah. Reaksi ini menjalani peneutralan pada tahap yang berbeza, bergantung kepada kekuatan asid dan asas.
Apakah perbezaan antara penyamaan dan peneutralan?
Perbezaan utama antara penyamaan dan peneutralan ialah penyamaan merujuk kepada pengimbangan atom -atom persamaan tindak balas kimia manakala peneutralan adalah pengimbangan keasidan atau asas untuk mendapatkan penyelesaian neutral. Selain itu, penyamaan melibatkan penggunaan bilangan atom dalam reaktan dan produk dan menggunakan keadaan pengoksidaan atom, sedangkan peneutralan melibatkan menentukan kekuatan asid dan asas yang terlibat dalam reaksi.
Di bawah infographic meringkaskan perbezaan antara penyamaan dan peneutralan.
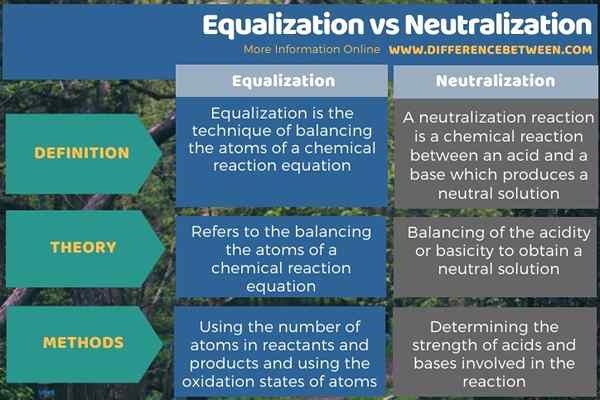
Ringkasan -Penyamaan vs peneutralan
Walaupun istilah penyamaan dan peneutralan bunyi serupa, mereka berbeza antara satu sama lain dalam definisi dan aplikasi. Perbezaan utama antara penyamaan dan peneutralan ialah penyamaan merujuk kepada mengimbangi atom persamaan tindak balas kimia, sedangkan peneutralan adalah mengimbangi keasidan atau asas untuk mendapatkan penyelesaian neutral.
Ihsan gambar:
2. "Titolazion" oleh Luigi Chiesa - Ditarik oleh Luigi Chiesa (Domain Awam) melalui Commons Wikimedia


