Perbezaan antara entalpi pemisahan atomisasi dan ikatan
The Perbezaan utama Antara enthalpi pemisahan dan pemisahan ikatan ialah Entalpi atomisasi menggambarkan tenaga yang diperlukan untuk memisahkan molekul ke dalam atomnya sedangkan enthalpi pemisahan bon menggambarkan pemisahan ikatan kimia dalam molekul.
Kadang -kadang, enthalpi pengabosan dan entalpi pemisahan ikatan adalah sama untuk beberapa sebatian mudah jika ada ikatan mudah. Ini kerana, dalam sebatian mudah, pemisahan ikatan membentuk atom dari mana molekul dibuat.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah enthalpy atomisation
3. Apakah entalpi pemisahan bon
4. Perbandingan sampingan -entalpi pengabosan vs pemisahan ikatan dalam bentuk tabular
5. Ringkasan
Apakah enthalpy atomisation?
Entalpi atomisasi adalah perubahan entalpi yang berlaku ketika memisahkan bahan kimia sepenuhnya ke dalam atomnya. Bahan kimia ini boleh menjadi elemen kimia atau sebatian kimia. Kita boleh menunjukkan perubahan entalpi ini sebagai ΔHpada. Semasa proses atomisasi, semua jenis ikatan kimia dipecahkan, dan tidak ada yang terbentuk. Oleh itu, enthalpi pengabosan adalah nilai positif. Nilai entalpi standard untuk perubahan entalpi ini adalah "entalpi standard atomisasi". Keadaan standard yang dipertimbangkan dalam konteks ini ialah 268.Suhu 15 k dan 1 tekanan bar.
Sebagai contoh, entalpi atomisasi untuk molekul air merujuk kepada tenaga yang diperlukan untuk memisahkan dua atom hidrogen dan atom oksigen dalam molekul air. Dalam erti kata lain, enthalpi pengabosan air adalah jumlah tenaga pemisahan ikatan dua ikatan O-H. Begitu juga, enthalpy pengabosan untuk pepejal unsur adalah enthalpy sublimasi untuk bahan itu kerana sublimasi melibatkan penukaran pepejal menjadi gas monoatomik apabila penyejatan.
Apakah entalpi pemisahan bon?
Enthalpi pemisahan bon menggambarkan perubahan entalpi yang berlaku semasa pemisahan ikatan kimia. Dengan kata lain, ia adalah ukuran kekuatan ikatan kimia. Oleh itu, kita boleh mengatakan bahawa perubahan entalpi standard yang berlaku apabila ikatan kimia A-b runtuh oleh hemolisis dan serpihan a dan b adalah entalpi pemisahan bon. Sekiranya molekul yang kita sedang mempertimbangkan adalah molekul diatomik, maka entalpi pemisahan ikatan sama dengan enthalpi atomisasi. Biasanya, serpihan A dan B yang diberikan oleh pemisahan bon ini adalah spesies radikal. Kita boleh menandakan entalpi pemisahan ikatan sebagai DH0.

Terdapat kaedah yang berbeza yang boleh kita gunakan untuk mengukur pemisahan bon seperti penentuan spektrometrik tahap tenaga, penjanaan radikal oleh pirolisis atau fotolisis, pengukuran kinetik kimia dan keseimbangan, pelbagai kaedah kalorimetrik dan elektrokimia, dan lain -lain.
Apakah perbezaan antara entalpi pemisahan dan pemisahan ikatan?
Perbezaan utama antara enthalpi pemisahan dan pemisahan ikatan adalah bahawa enthalpy atomisasi menggambarkan tenaga yang diperlukan untuk memisahkan molekul ke dalam atomnya sedangkan enthalpy pemisahan bon menggambarkan pemisahan ikatan kimia dalam molekul. Entalpi pemisahan ikatan dan entalpi pengabosan adalah nilai positif. Kadang -kadang, enthalpi atomisasi dan entalpi pemisahan ikatan adalah sama untuk beberapa sebatian mudah jika ada ikatan mudah. Walau bagaimanapun, istilah ini berbeza antara satu sama lain.
Di bawah jadual infographic lebih banyak perbezaan antara entalpi pemisahan dan pemisahan ikatan.
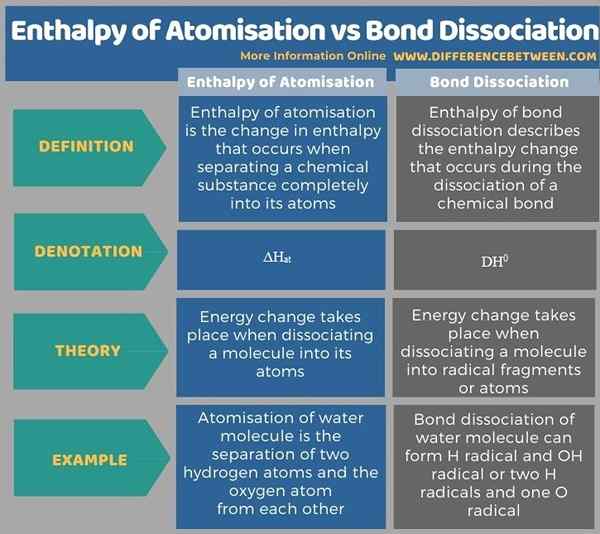
Ringkasan -Enthalpy of Atomisation vs Bond Dissociation
Enthalpi pemisahan dan pemisahan ikatan boleh digunakan secara bergantian untuk beberapa sebatian mudah, tetapi tidak selalu mereka bersamaan. Perbezaan utama antara enthalpi pemisahan dan pemisahan ikatan adalah bahawa enthalpy atomisasi menggambarkan tenaga yang diperlukan untuk memisahkan molekul ke dalam atomnya sedangkan enthalpy pemisahan bon menggambarkan pemisahan ikatan kimia dalam molekul.
Rujukan:
1. "Entalpi atomisasi."Wikipedia, boleh didapati di sini.
Ihsan gambar:
1. "Heterolisis (Kimia)" oleh Jürgen Martens - Jürgen Martens (CC By -SA 3.0) melalui Commons Wikimedia


