Perbezaan antara EDTA dan EGTA
EDTA VS EGTA
EDTA dan EGTA kedua -duanya adalah agen chelating. Kedua -duanya adalah asid karboksilik poliamino dan mempunyai lebih kurang sifat yang sama.
EDTA
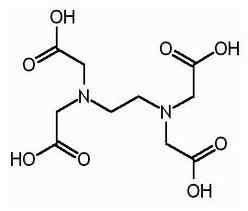
EDTA adalah nama yang dipendekkan untuk asid tetraacetic etilena diamine. Ia juga dikenali sebagai asid tetraacetic (etilena dinitrilo). Berikut adalah struktur EDTA.

Molekul EDTA mempunyai enam tapak di mana ion logam dapat terikat. Terdapat dua kumpulan amino dan empat kumpulan karboksil. Kedua -dua atom nitrogen kumpulan amino mempunyai pasangan elektron yang tidak disesuaikan. EDTA adalah ligan hexadentate. Juga, ia adalah ejen chelating kerana keupayaan untuk mengikat ion logam. EDTA membentuk chelates dengan semua kation kecuali logam alkali dan chelates ini cukup stabil. Hasil kestabilan dari beberapa tapak kompleks dalam molekul yang menimbulkan sangkar seperti struktur yang mengelilingi ion logam. Ini mengasingkan ion logam dari molekul pelarut, dengan itu mencegah solvation. Kumpulan karboksil EDTA boleh memisahkan proton menderma; Oleh itu, EDTA mempunyai sifat berasid. Pelbagai spesies EDTA disingkat sebagai h4Y, h3Y-, H2Y2-, Hy3- dan y4-. Pada pH yang sangat rendah (medium berasid), bentuk edta proton (h4Y) adalah dominan. Sebaliknya, pada pH tinggi (medium asas), bentuk deprotonasi sepenuhnya (y4-) mendominasi. Dan apabila pH berubah dari pH rendah ke pH tinggi, bentuk lain EDTA mendominasi dalam nilai pH tertentu. EDTA tersedia sebagai bentuk protonasi sepenuhnya atau sama ada bentuk garam. Disodium edta dan kalsium disodium edta adalah bentuk garam yang paling biasa ada. Asid percuma h4Y dan dihydrate garam natrium na2H2Y.2h2O boleh didapati secara komersil dalam kualiti reagen.
Apabila larut dalam air, EDTA bertindak seperti asid amino. Ia wujud sebagai zwitterion berganda. Pada kesempatan ini, caj bersih adalah sifar, dan terdapat empat proton yang dissociable (dua proton dikaitkan dengan kumpulan karboksil dan dua yang berkaitan dengan kumpulan amina). EDTA digunakan secara meluas sebagai titran kompleksometrik. Penyelesaian EDTA adalah penting sebagai titran kerana ia menggabungkan dengan ion logam dalam nisbah 1: 1 tanpa mengira caj pada kation. EDTA juga digunakan sebagai pengawet untuk sampel biologi. Sebilangan kecil ion logam yang terdapat dalam sampel biologi, dan makanan dapat memangkinkan pengoksidaan udara sebatian yang terdapat dalam sampel. EDTA Kompleks dengan ketat ion logam ini, dengan itu menghalang mereka daripada memangkinkan pengoksidaan udara. Itulah sebabnya boleh digunakan sebagai pengawet.
EGTA
EGTA adalah istilah disingkat untuk asid tetraacetic etilena glikol.Ia adalah ejen chelating, dan sangat mirip dengan EDTA. EGTA mempunyai pertalian yang lebih tinggi untuk ion kalsium daripada ion magnesium. EGTA mempunyai struktur berikut.
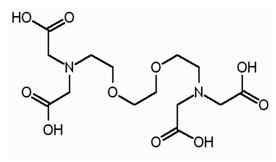
Sama dengan EDTA, EGTA juga mempunyai empat kumpulan karboksil, yang boleh menghasilkan empat proton apabila pemisahan. Terdapat dua kumpulan amina dan dua atom nitrogen kumpulan amino mempunyai pasangan elektron yang tidak disesuaikan. EGTA boleh digunakan sebagai penampan untuk menyerupai pH sel hidup. Harta EGTA ini membenarkan penggunaannya dalam penyucian afiniti, yang merupakan teknik pemurnian protein.
| Apakah perbezaan antara EDTA dan EGTA? • EDTA adalah asid tetraacetic etilena diamine dan EGTA adalah asid etilena glikol tetraacetic. • EGTA mempunyai berat molekul yang lebih tinggi daripada EDTA. • Selain daripada empat kumpulan karboksil, dua kumpulan amino, EGTA juga mempunyai dua lagi atom oksigen dengan elektron yang tidak disesuaikan. • EGTA mempunyai pertalian yang lebih tinggi untuk ion kalsium berbanding EDTA. Dan EDTA mempunyai pertalian yang lebih tinggi untuk ion magnesium berbanding dengan EGTA. • EGTA mempunyai titik mendidih yang lebih tinggi daripada EDTA. |


