Perbezaan antara keadaan kovalensi dan pengoksidaan
Perbezaan Utama - Kovalensi vs Keadaan pengoksidaan
Atom unsur kimia yang berbeza terikat antara satu sama lain yang membentuk sebatian kimia yang berbeza. Dalam pembentukan sebatian, atom -atom terikat antara satu sama lain melalui ikatan ionik atau ikatan kovalen. Keadaan kovalensi dan pengoksidaan adalah dua istilah yang menggambarkan keadaan atom -atom ini dalam sebatian kimia. Kovalensi adalah bilangan ikatan kovalen yang dapat dibentuk oleh atom. Oleh itu, kovalensi bergantung kepada bilangan elektron yang dapat dikongsi atom dengan atom lain. Keadaan pengoksidaan atom adalah bilangan elektron yang diperoleh atau hilang oleh atom tertentu ketika membentuk ikatan kimia. The Perbezaan utama antara keadaan kovalensi dan pengoksidaan ialah Kovalensi atom adalah bilangan ikatan kovalen yang dapat dibentuk atom manakala keadaan pengoksidaan atom adalah bilangan elektron yang hilang atau diperoleh oleh atom ketika membentuk ikatan kimia.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu covalency
3. Apakah keadaan pengoksidaan
4. Perbandingan sampingan - Kovalensi vs keadaan pengoksidaan dalam bentuk jadual
5. Ringkasan
Apa itu covalency?
Kovalensi adalah bilangan ikatan kovalen yang dapat dibentuk oleh atom dengan atom lain. Oleh itu, covalency ditentukan oleh bilangan elektron yang terdapat di orbital paling luar atom. Walau bagaimanapun, istilah valensi dan kovalensi tidak boleh dikelirukan kerana mereka mempunyai makna yang berbeza. Valency adalah kuasa menggabungkan atom. Kadang -kadang, kovalensi sama dengan valensi. Namun, ia tidak selalu berlaku.
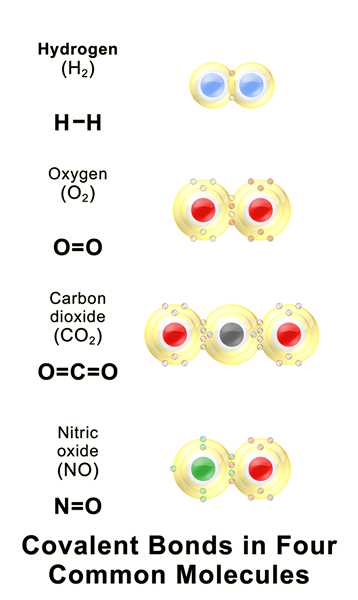
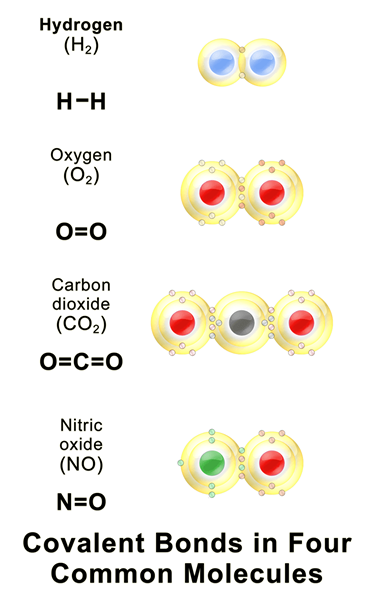
Rajah 01: Beberapa sebatian kovalen biasa
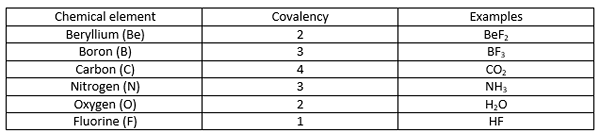
Ikatan kovalen adalah ikatan kimia yang terbentuk apabila dua atom berkongsi elektron paling tidak berpasangan mereka untuk menyelesaikan konfigurasi elektron. Apabila atom mempunyai kerang elektron yang tidak lengkap atau orbital, atom itu menjadi lebih reaktif kerana konfigurasi elektron yang tidak lengkap tidak stabil. Oleh itu, atom -atom ini sama ada mendapat/longgar elektron atau elektron saham untuk mengisi kerang elektron. Jadual berikut menunjukkan beberapa contoh elemen kimia dengan nilai kovalensi yang berbeza.
Apakah keadaan pengoksidaan?
Pengoksidaan Keadaan atom adalah bilangan elektron yang hilang, diperoleh atau dikongsi oleh atom itu dengan atom lain. Sekiranya elektron hilang atau diperoleh, caj elektrik atom ditukar dengan sewajarnya. Elektron dicas negatif zarah subatomik yang cajnya dinetralkan oleh caj positif proton dalam atom tersebut. Apabila elektron hilang, atom mendapat caj positif manakala apabila elektron diperoleh, atom mendapat caj negatif bersih. Ini berlaku kerana ketidakseimbangan caj positif proton dalam nukleus. Caj ini dapat diberikan sebagai keadaan pengoksidaan atom itu.
Keadaan pengoksidaan atom dilambangkan oleh jumlah keseluruhan dengan tanda positif (+) atau negatif (-). Tanda ini menunjukkan sama ada atom telah memperoleh atau kehilangan elektron. Nombor keseluruhan memberikan bilangan elektron yang telah ditukar antara atom.
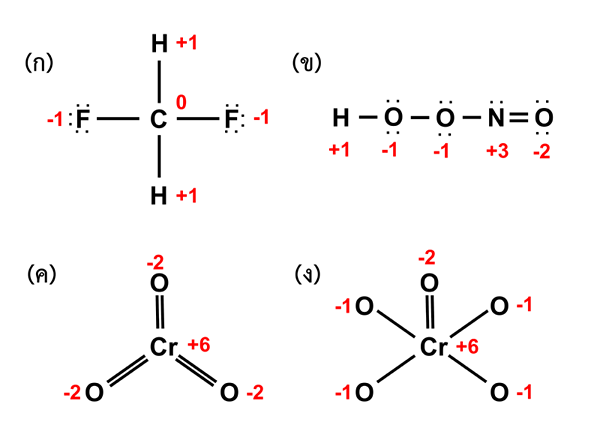
Rajah 02: Keadaan pengoksidaan sebatian yang berbeza
Penentuan keadaan pengoksidaan atom
Keadaan pengoksidaan atom tertentu dapat ditentukan dengan menggunakan peraturan berikut.
- Keadaan pengoksidaan unsur neutral selalu sifar. Cth: keadaan pengoksidaan natrium (NA) adalah sifar.
- Jumlah tuduhan sebatian harus sama dengan jumlah tuduhan setiap atom yang ada di sebatian itu. Cth: Jumlah caj KCl adalah sifar. Kemudian caj K dan Cl mestilah +1 dan -1.
- Keadaan pengoksidaan elemen kumpulan 1 selalu +1. Unsur Kumpulan 1 adalah litium, natrium, kalium, rubidium, cesium dan francium.
- Keadaan pengoksidaan elemen kumpulan 2 selalu +2. Elemen Kumpulan 2 adalah berilium, magnesium, kalsium, strontium, barium dan radium.
- Caj negatif diberikan kepada atom yang mempunyai elektronegativiti yang lebih tinggi daripada atom lain yang terikat kepadanya.
- Keadaan pengoksidaan hidrogen selalu +1 kecuali apabila hidrogen terikat kepada logam kumpulan 1.
- Keadaan pengoksidaan oksigen adalah -2 kecuali apabila ia dalam bentuk peroksida atau superoxide.
Apakah perbezaan antara keadaan kovalensi dan pengoksidaan?
Keadaan kovalensi vs pengoksidaan | |
| Kovalensi adalah bilangan ikatan kovalen yang dapat dibentuk oleh atom dengan atom lain. | Pengoksidaan Keadaan atom adalah bilangan elektron yang hilang, diperoleh atau dikongsi oleh atom itu dengan atom lain. |
| Caj elektrik | |
| Covalency tidak menunjukkan caj elektrik atom. | Keadaan pengoksidaan memberikan caj elektrik atom. |
| Ikatan kimia | |
| Kovalensi menunjukkan bilangan ikatan kimia (ikatan kovalen) yang boleh dimiliki oleh atom tertentu. | Keadaan pengoksidaan tidak memberikan butiran mengenai ikatan kimia yang dibentuk oleh atom. |
| Keadaan elemen | |
| Kovalensi elemen murni bergantung pada bilangan elektron yang terdapat di dalam shell elektron paling luar atom elemen tersebut. | Keadaan pengoksidaan elemen murni selalu sifar. |
Ringkasan - Covalency vs Keadaan pengoksidaan
Keadaan kovalensi dan pengoksidaan atom menggambarkan sifat kimia atom dalam sebatian kimia. Perbezaan antara kovalensi dan keadaan pengoksidaan adalah bahawa kovalensi atom adalah bilangan ikatan kovalen yang dapat dibentuk atom manakala keadaan pengoksidaan atom adalah bilangan elektron yang hilang atau diperoleh oleh atom ketika membentuk ikatan kimia.
Rujukan:
1."Kovalensi."Com, kamus.com. Terdapat di sini
2."Negeri Pengoksidaan."Wikipedia, Yayasan Wikimedia, 5 Mac. 2018. Terdapat di sini
3."Kimia-Kovalensi dan Struktur Molekul."Com. Terdapat di sini
Ihsan gambar:
1.'Covalent Bonds'by Bruceblaus - Kerja Sendiri, (CC BY -SA 4.0) melalui Commons Wikimedia
2.'Tugasan Negeri Pengoksidaan' oleh Saranphong Yimklan - Kerja Sendiri, (Domain Awam) melalui Commons Wikimedia


