Perbezaan antara asid konjugasi dan asas konjugasi
The Perbezaan utama Antara asid konjugasi dan asas konjugasi ialah Asid konjugasi menderma proton, sedangkan pangkalan konjugasi menerima proton.
Pada tahun 1923, dua saintis, Bronsted dan Lowry menyampaikan teori mengenai tingkah laku asid. Menurut Bronsted - Lowry Theory, asid adalah penderma proton, dan pangkalan adalah penerima proton. Oleh itu, molekul untuk berkelakuan sebagai asid harus menemui penerima proton. Sebaliknya, molekul untuk berkelakuan sebagai pangkalan yang harus menemui penderma proton. Oleh itu, untuk tindak balas asid, kedua-dua penderma dan penerima proton harus berada di sana. Walau bagaimanapun, air boleh bertindak sebagai asid dan asas. Apabila air menerima proton, ia membentuk ion hidronium, dan apabila ia menyumbangkan proton, ia menghasilkan ion hidroksida.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Asid Konjugasi
3. Apa itu asas konjugasi
4. Perbandingan sampingan - Asid Conjugate Vs Base Conjugate dalam Bentuk Tabular
5. Ringkasan
Apa itu Asid Konjugasi?
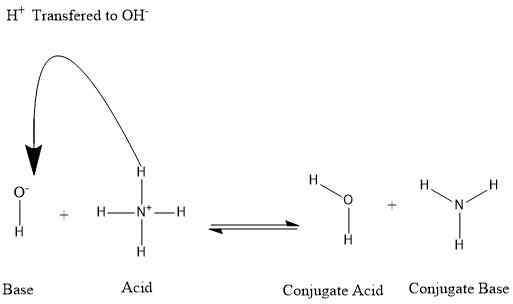
Asid konjugasi adalah bahan yang dibuat dari asas. Apabila pangkalan menerima proton dari molekul lain, ia membentuk asid konjugasi. Asid konjugasi dapat mengeluarkan elektron dan kembali ke pangkalan induk. Oleh itu, asid konjugasi mempunyai sifat berasid.

Rajah 01: Pembentukan Asid Konjugasi dan Pangkalan Konjugasi
Sebagai contoh, kita dapat mempertimbangkan keadaan di mana ammonia larut dalam air.
NH3+ H2O ⇌ nh4+ + Oh-
Dalam contoh di atas, ion ammonium adalah asid conjugate ammonia. Begitu juga, apabila mempertimbangkan reaksi mundur, air adalah asid conjugate asas hidroksida.
Apa itu asas konjugasi?
Pangkalan konjugasi adalah bahan yang terbentuk selepas asid memberikan proton ke pangkalan. Tetapi, ini boleh menerima proton lagi; Oleh itu, ia mempunyai ciri -ciri asas. Penerima proton yang berpotensi yang terbentuk dari asid induk adalah asas konjugasi. Apabila asas konjugasi menerima proton, ia terbalik kepada asid induk lagi.
Selain itu, banyak pelarut boleh bertindak sebagai penderma atau penerima proton. Oleh itu, mereka boleh mendorong tingkah laku berasid atau asas dalam larutan. Sebagai contoh, apabila ammonia larut dalam air, air bertindak sebagai asid dan memberikan proton kepada ammonia, dan dengan itu, membentuk ion ammonium. Sementara itu, molekul air ditukar kepada anion hidroksida. Di sini, pangkalan konjugasi air adalah anion hidroksida. Dan asas konjugasi ammonium adalah ammonia.
Apakah perbezaan antara asid konjugasi dan asas konjugasi?
Perbezaan utama antara asid konjugasi dan asas konjugasi ialah asid konjugasi boleh mendermakan proton, sedangkan pangkalan konjugasi dapat menerima proton. Selain itu, asid konjugasi terbentuk dari pangkalan; Sebaliknya, pangkalan konjugasi terbentuk dari asid. Walau bagaimanapun, asid dan asas konjugasi yang terbentuk dalam tindak balas spontan jauh lebih lemah daripada molekul induk mereka.

Ringkasan -Asid Konjugasi Vs Base Conjugate
Asid Konjugasi dan Pangkalan Konjugasi adalah sepasang spesies kimia yang mempunyai tingkah laku kimia yang bertentangan. Perbezaan utama antara asid konjugasi dan asas konjugasi ialah asid konjugasi boleh mendermakan proton, sedangkan pangkalan konjugasi dapat menerima proton.
Rujukan:
1. Libretexts. "11.12: Pasangan Asid Asid Konjugasi."Kimia Libretexts, Yayasan Sains Kebangsaan, 26 Nov. 2018. Terdapat di sini
Ihsan gambar:
1."Reaksi Pangkalan Konjugasi" oleh Schlenk (CC BY-SA 3.0) melalui Commons Wikimedia


