Perbezaan antara karbonat dan bikarbonat
The Perbezaan utama antara karbonat dan bikarbonat adalah Ion karbonat mempunyai -2 cas elektrik sedangkan, bikarbonat mempunyai -1 caj elektrik.
Tubuh manusia menghasilkan karbon dioksida sebagai produk sampingan metabolisme. Sebilangan besar karbon dioksida ini larut dalam plasma darah dan hadir dalam bentuk bikarbonat. Sistem karbonat dan bikarbonat terutamanya bertanggungjawab untuk mengekalkan nilai pH darah kita, dan mereka bertindak sebagai penampan dalam darah kita. Apabila karbon dioksida larut dalam bentuk air, bikarbonat dan asid karbonik, dan terdapat keseimbangan antara spesies ini.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Karbonat
3. Apa itu bikarbonat
4. Perbandingan sampingan - Karbonat vs bikarbonat dalam bentuk jadual
5. Ringkasan
Apa itu Karbonat?
Karbonat adalah ion bukan organik yang mengandungi atom karbon dan tiga atom oksigen. Ia mempunyai caj divalen negatif (-2 caj elektrik). Ion karbonat mempunyai geometri planar trigonal, dan berat molekulnya adalah 60 g mol-1.
Walaupun struktur lewis ion karbonat mempunyai satu ikatan double karbon-oksigen dan dua ikatan tunggal karbon-oksigen, bukan struktur sebenar. Ion karbonat menunjukkan penstabilan resonans. Oleh itu, ia mempunyai struktur hibrid semua struktur resonans. Oleh itu, semua ikatan karbon-oksigen mempunyai panjang yang sama, dan atom oksigen mempunyai caj negatif separa (oleh itu, semua atom oksigen adalah serupa.).
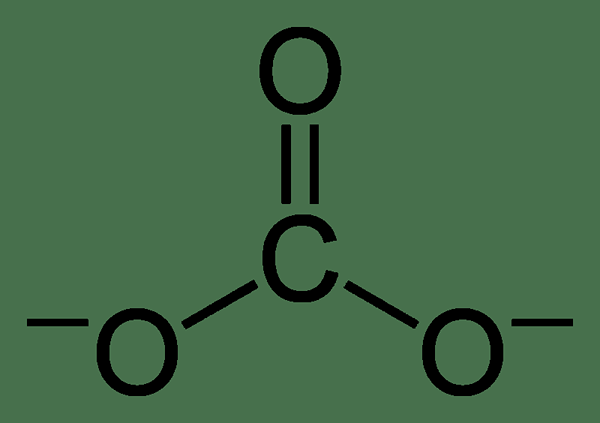
Rajah 01: Struktur kimia ion karbonat
Apabila karbon dioksida atau bikarbonat larut dalam air, ion karbonat membentuk. Dan, ion ini berada dalam keseimbangan dengan ion bikarbonat. Sememangnya, ia menggabungkan dengan ion logam lain atau ion positif lain untuk membuat sebatian. Terdapat pelbagai jenis batu karbonat, seperti batu kapur (kalsium karbonat), dolomit (kalsium-magnesium karbonat), potash (kalium karbonat) dan lain-lain.
Tambahan pula, sebatian karbonat memainkan peranan penting dalam kitaran karbon. Dengan masa, sebatian yang mengandungi karbon ditukar menjadi batu sedimen apabila mereka mendepositkan untuk masa yang lama. Kemudian, ketika batu -batu ini berlindung, karbon dioksida dibebaskan kembali ke atmosfera. Begitu juga, ketika memanaskan sebatian ini, mereka melepaskan karbon dioksida dengan mudah. Selanjutnya, sebatian karbonat adalah ionik, dan mereka tidak larut dalam air.
Apa itu bikarbonat?
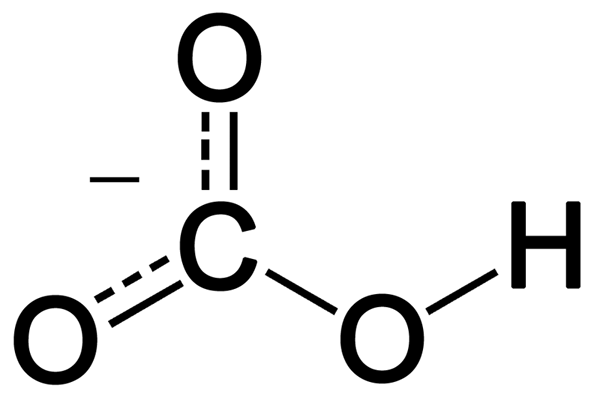
Bikarbonat adalah anion monovalen yang mempunyai satu hidrogen, satu karbon dan tiga atom oksigen. Ia terbentuk daripada deprotonasi asid karbonik. Ia mempunyai geometri planar trigonal di sekitar atom karbon pusat. Ion bikarbonat mempunyai berat molekul 61 g mol-1.

Rajah 02: Struktur resonans ion bikarbonat
Selain itu, ion ini menunjukkan penstabilan resonans antara dua atom oksigen, yang tidak disambungkan ke hidrogen. Secara semula jadi, bikarbonat adalah alkali, dan ia adalah asid konjugasi ion karbonat dan asas konjugasi asid karbonik. Selain itu, ion yang dikenakan positif dapat bergabung dengan oksigen yang dikenakan secara negatif dalam ion ini dan membentuk garam ionik. Garam bikarbonat yang paling biasa adalah natrium bikarbonat, yang kami namakan sebagai serbuk penaik dalam penggunaan seharian. Selain itu, sebatian bikarbonat melepaskan karbon dioksida apabila bertindak balas dengan asid.
Apakah perbezaan antara karbonat dan bikarbonat?
Karbonat dan bikarbonat adalah anion bukan organik. Perbezaan utama antara karbonat dan bikarbonat adalah bahawa ion karbonat mempunyai -2 cas elektrik sedangkan, bikarbonat mempunyai -1 caj elektrik. Selain itu, disebabkan kehadiran atom hidrogen, jisim molar ion karbonat adalah 60 g/mol manakala jisim molar ion bikarbonat adalah 61 g/mol.
Satu lagi perbezaan yang signifikan antara karbonat dan bikarbonat ialah, dalam keadaan yang sangat asas, akan ada lebih banyak ion karbonat, sedangkan, ion bikarbonat akan lebih banyak dalam penyelesaian asas yang lemah. Selain itu, keupayaan untuk membubarkan air juga menyumbang kepada perbezaan antara karbonat dan bikarbonat. Itu dia; sebatian dengan ion karbonat tidak larut dalam air pada suhu bilik dan tekanan atmosfera. Walau bagaimanapun, banyak garam bikarbonat larut dalam air pada suhu bilik.
Berikut adalah ringkasan perbezaan antara karbonat dan bikarbonat dalam bentuk jadual.
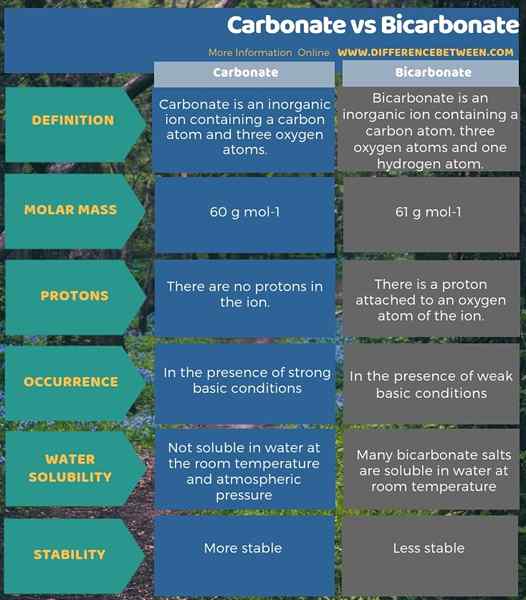
Ringkasan -Karbonat vs bikarbonat
Kedua -dua karbonat dan bikarbonat adalah ion yang mengandungi atom karbon dan oksigen. Walau bagaimanapun, ion bikarbonat mempunyai atom hidrogen juga. Oleh itu, atom hidrogen ini menyebabkan ion menjadi anion monovalen manakala karbonat adalah anion divalen. Ringkasnya, perbezaan utama antara karbonat dan bikarbonat adalah bahawa ion karbonat mempunyai caj elektrik -2 sedangkan, bikarbonat mempunyai -1 caj elektrik.
Rujukan:
1. Britannica, editor Encyclopaedia. "Karbonat."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 20 Julai 1998. Terdapat di sini
2. "Bikarbonat ion."Pusat Kebangsaan Maklumat Bioteknologi. Pangkalan data kompaun pubchem, u.S. Perpustakaan Perubatan Negara. Terdapat di sini
Ihsan gambar:
1."Karbonat-Ion-Localised-2D" oleh Ben Mills-Kerja Sendiri, (Domain Awam) melalui Commons Wikimedia
2."Bicarbonate-Resonance" oleh Hellbus-Kerja Sendiri, (CC BY-SA 3.0) melalui Commons Wikimedia


