Perbezaan antara karbon 12 dan karbon 14
The Perbezaan utama antara karbon 12 dan karbon 14 ialah Karbon 12 mempunyai 6 neutron dalam nukleus atomnya manakala karbon 14 mempunyai 8 neutron.
Karbon 12 dan Karbon 14 adalah isotop atom karbon. Atom karbon selalu mempunyai 6 proton. Ia biasanya mempunyai 6 neutron juga, itulah sebabnya kita menyebutnya karbon 12. Tetapi kadang -kadang terdapat 8 neutron dan bukannya 6, iaitu ketika ia menjadi karbon 14. Dalam tindak balas kimia, karbon 12 dan karbon 14 berkelakuan dengan cara yang sama. Umumnya, karbon terdapat dalam keadaan C 12, tetapi kadang -kadang ia juga boleh didapati sebagai C 14.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Karbon 12
3. Apa itu Karbon 14
4. Perbandingan sampingan - Karbon 12 vs Karbon 14 dalam bentuk jadual
5. Ringkasan
Apa itu Karbon 12?
Karbon 12 adalah isotop karbon semulajadi yang paling biasa, Massa 12. Ia adalah asas bagi skala unit jisim atom yang diterima. Kelimpahan karbon ini sekitar 99%.

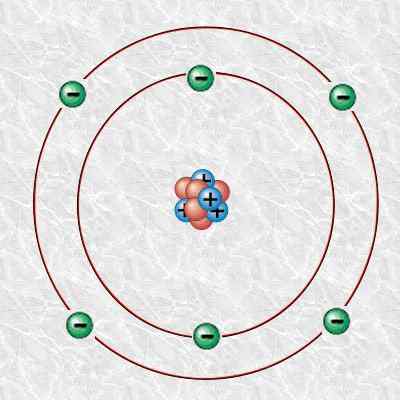
Rajah 1: Atom karbon
Tambahan pula, atom karbon ini terdiri daripada 6 proton, 6 elektron, dan 6 neutron. Kita boleh menandakan karbon 12 secara saintifik sebagai 12c. Jisim isotopnya adalah 12 u.
Apa itu Karbon 14?
Karbon 14 adalah isotop biasa karbon. Kami menyebutnya "radiokarbon" kerana ia adalah isotop karbon radioaktif. Nukleus atom atom ini mengandungi 6 proton, 6 elektron, dan 8 neutron. Jisim isotopnya ialah 14 u. Selain itu, karbon 14 sangat jarang berlaku, dan kelimpahannya adalah kira -kira 1 bahagian per trilion.
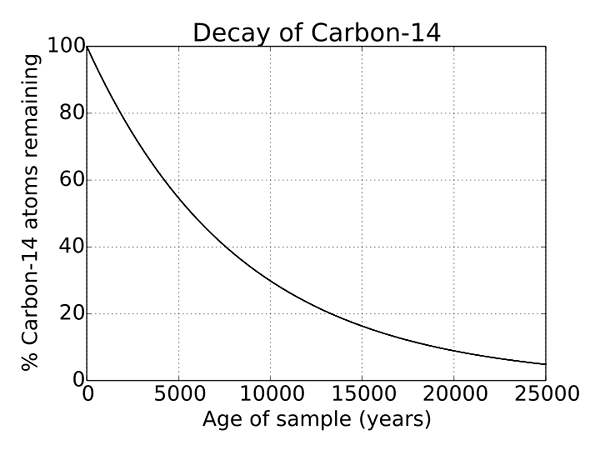
Rajah 2: Kerosakan radioaktif karbon 14
Oleh kerana C 14 adalah isotop yang tidak stabil dari atom karbon, ia mengalami kerosakan radioaktif. Dan ini adalah proses yang berlaku untuk setiap isotop yang tidak stabil dan merupakan proses semula jadi. Ia adalah harta yang unik dari C 14 dan digunakan untuk penentuan objek yang beribu -ribu tahun dan digunakan secara meluas dalam arkeologi. Separuh hayat C 14 adalah 5730 tahun.
Apakah perbezaan antara karbon 12 dan karbon 14?
C 12 dan C 14 adalah isotop atom karbon. Perbezaan utama antara karbon 12 dan karbon 14 ialah karbon 12 mempunyai 6 neutron dalam nukleus atomnya manakala karbon 14 mempunyai 8 neutron. Oleh kerana berat proton dan neutron adalah sama, mempunyai 8 neutron, c 14 adalah 20% lebih berat daripada c 12. Tambahan pula, kerana kedua -dua C 12 dan C 14 mempunyai bilangan proton yang sama, nombor atom mereka adalah sama, tetapi berat atom mereka berbeza kerana bilangan neutron yang berlainan. Jadi, ini adalah perbezaan yang signifikan antara C 12 dan C 14.
Lebih -lebih lagi, C 12 dan C 14 juga berkelakuan berbeza ketika datang ke reaksi nuklear. Juga, perbezaan selanjutnya antara C 12 dan C 14 adalah bahawa C 12 ditemui dengan banyaknya di kerak bumi sementara C 14 jarang berlaku. Selain itu, C 12 adalah isotop karbon yang stabil manakala C 14 adalah isotop yang tidak stabil dari atom karbon dan mengalami kerosakan radioaktif.

Ringkasan -Karbon 12 vs Karbon 14
Karbon 12 dan Karbon 14 adalah isotop atom karbon. Atom karbon selalu mempunyai 6 proton, tetapi bilangan neutron boleh berbeza -beza. Sebagai contoh, karbon 12 dan karbon 14 adalah isotop karbon yang berbeza yang mempunyai bilangan neutron yang berlainan. Oleh itu, perbezaan utama antara karbon 12 dan karbon 14 ialah karbon 12 mempunyai 6 neutron dalam nukleus atomnya manakala karbon 14 mempunyai 8 neutron.
Rujukan:
1. "Karbon."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 7 Feb. 2019, boleh didapati di sini.
Ihsan gambar:
1. "Karbon-atom" oleh Alejandro Porto-Kerja Sendiri (CC BY-SA 3.0) melalui Commons Wikimedia
2. "Pereputan Radioaktif Karbon-14 SVG" oleh Exeterpaul-Kerja Sendiri (CC BY-SA 3.0) melalui Commons Wikimedia


