Perbezaan antara bromin dan bromida

The Perbezaan utama antara bromin dan bromida adalah bromida adalah bentuk bromin yang dikurangkan.
Unsur -unsur kimia dalam jadual berkala tidak stabil kecuali gas mulia. Oleh itu, unsur -unsur cuba bertindak balas dengan unsur -unsur lain untuk mendapatkan konfigurasi elektron gas mulia untuk mencapai kestabilan. Begitu juga, bromin juga perlu mendapatkan elektron untuk mencapai konfigurasi elektron krypton gas mulia. Semua logam bertindak balas dengan bromin, membentuk bromida. Bromin dan bromida mempunyai sifat fizikal dan kimia yang berbeza kerana perubahan satu elektron.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Bromine
3. Apa itu bromida
4. Perbandingan sampingan - Bromine vs bromida dalam bentuk jadual
5. Ringkasan
Apa itu Bromine?
Bromin adalah elemen kimia dalam jadual berkala yang dilambangkan oleh BR. Ia adalah halogen (17th kumpulan) dalam 4th Tempoh jadual berkala. Bilangan atom bromin adalah 35; Oleh itu, ia mempunyai 35 proton dan 35 elektron. Konfigurasi elektronnya ialah [AR] 4S2 3d10 4p5. Sejak p Sublevel harus mempunyai 6 elektron untuk mendapatkan konfigurasi elektron gas Krypton Noble, Bromine mempunyai keupayaan untuk menarik elektron. Ia mempunyai elektronegativiti yang tinggi, iaitu kira -kira 2.96, mengikut skala Pauling.
Berat atom bromin adalah 79.904 amu. Di bawah suhu bilik, ia wujud sebagai molekul diatomik (BR2). Juga, molekul diatom ini adalah cecair warna merah coklat. Bromine mempunyai titik lebur sebanyak 265.8 k dan titik mendidih 332.0 k.
Sifat bromin selanjutnya
Di antara semua isotop bromin, BR-79 dan BR-81 adalah isotop yang paling stabil. Selanjutnya, elemen kimia ini sedikit larut dalam air tetapi larut dalam pelarut organik seperti kloroform. Selain itu, ia mempunyai negeri pengoksidaan 7, 5, 4, 3, 1, -1.
Kereaktifan kimia bromin terletak di antara klorin dan iodin. Bromin kurang reaktif daripada klorin tetapi lebih reaktif daripada yodium. Bromine menghasilkan ion bromida dengan mengambil satu elektron. Oleh itu, bromin mengambil bahagian dalam pembentukan kompaun ionik dengan mudah. Sebenarnya, dalam alam semula jadi, bromin wujud sebagai garam bromida dan bukannya Br2.

Rajah 01: bromin
Bromin dapat mengoksidakan anion unsur -unsur yang terletak di bawah bromin dalam jadual berkala. Walau bagaimanapun, ia tidak dapat mengoksida klorida untuk memberi klorin. Selain itu, kita boleh menghasilkan BR dengan merawat brin kaya bromida dengan gas klorin. Atau gas bromin lain dibentuk dengan merawat HBR dengan asid sulfurik. Bromin sangat berguna dalam industri dan makmal kimia. Sebatian bromida penting sebagai bahan tambahan petrol, untuk racun perosak dan sebagai pembasmi kuman dalam pembersihan air.
Apa itu bromida?
Bromida adalah anion yang membentuk apabila bromin abstrak elektron dari elemen elektropositif yang lain. Kita boleh mewakilinya dengan simbol br-. Ia adalah ion monovalen dengan caj -1. Oleh itu, ia mempunyai 36 elektron dan 35 proton.

Konfigurasi elektron bromida adalah [AR] 4S2 3d10 4p6. Ia wujud dalam sebatian ionik seperti natrium bromida, kalsium bromida dan HBr. Ia juga wujud secara semula jadi dalam sumber air.
Apakah perbezaan antara bromin dan bromida?
Bromin adalah elemen kimia dalam jadual berkala yang dilambangkan oleh BR sementara bromida adalah anion yang terbentuk apabila bromin abstrak elektron dari elemen elektropositif yang lain. Selain itu, perbezaan utama antara bromin dan bromida ialah bromida adalah bentuk bromin yang dikurangkan. Selain itu, bromida mempunyai 36 elektron berbanding 35 elektron bromin, tetapi kedua -duanya mempunyai 35 proton. Oleh itu, bromida mempunyai caj -1 manakala bromin adalah neutral.
Tambahan pula, bromin lebih reaktif kimia daripada bromida. Juga, perbezaan selanjutnya antara bromin dan bromida adalah bahawa bromida telah mencapai konfigurasi elektron Krypton dan, oleh itu, lebih stabil daripada atom bromin.
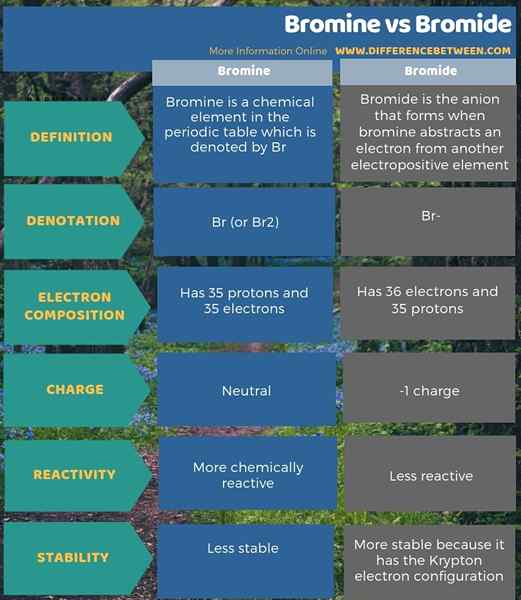
Ringkasan -Bromine vs Bromide
Bromin adalah elemen kimia dalam jadual berkala dan dilambangkan oleh BR. Sementara itu, bromida adalah anion yang terbentuk apabila bromin abstrak elektron dari elemen elektropositif yang lain. Selanjutnya, perbezaan utama antara bromin dan bromida ialah bromida adalah bentuk bromin yang dikurangkan.
Ihsan gambar:
1. "Bromine 25ml (telus)" oleh W. OELEN -(CC BY -SA 3.0) melalui Commons Wikimedia
2. "Br-" oleh Neurotiker - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


