Perbezaan antara momen bon dan momen dipole
Perbezaan utama - Momen Bond vs Dipole Moment
Istilah Momen Bond dan Momen Dipole didasarkan pada prinsip yang sama tetapi berbeza berdasarkan aplikasi. Momen ikatan juga dikenali sebagai momen dipole bon. Ia adalah polariti ikatan kimia yang terletak dalam molekul tertentu. Momen dipole, sebaliknya, adalah apa -apa jenis pemisahan elektrik (pemisahan caj). Perbezaan utama antara momen bon dan momen dipole ialah momen ikatan berlaku dalam ikatan kimia kovalen manakala momen dipole berlaku di antara dua ion dalam ikatan ionik atau di antara dua atom dalam ikatan kovalen.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Momen Bond
3. Apa momen dipole
4. Persamaan antara momen bon dan momen dipole
5. Perbandingan sampingan - momen bon vs momen dipole dalam bentuk jadual
6. Ringkasan
Apa itu Momen Bond?
Momen bon adalah pemisahan caj elektrik dalam ikatan kimia kovalen yang terdapat dalam sebatian kimia tertentu. Oleh itu, ia memberikan polariti ikatan kimia. Momen ikatan berlaku apabila terdapat pemisahan caj positif dan negatif dalam ikatan kimia. Momen dipole ikatan dilambangkan oleh simbol "μ".
μ = ΔD
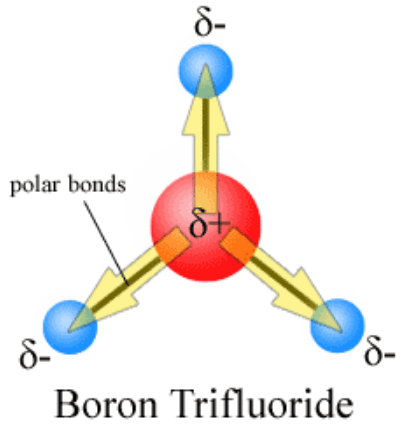
di mana, δ ialah nilai caj dan d ialah jarak antara dua atom dalam ikatan kovalen. Dalam penciptaan momen dipole ikatan, caj elektrik dipisahkan sebagai caj separa δ+ dan δ-. Pemisahan caj ini berlaku dalam ikatan kimia apabila dua atom yang mengambil bahagian dalam pembentukan ikatan mempunyai nilai elektronegativiti yang berbeza. Oleh kerana elektronegativiti atom adalah pertalian untuk elektron, lebih banyak atom elektronegatif menarik elektron ikatan ke arah mereka. Kemudian, atom dengan nilai elektronegatif yang kurang mendapat caj positif separa kerana ketumpatan elektron di sekeliling atom itu kurang. Begitu juga, atom yang mempunyai elektronegativiti yang tinggi mendapat caj negatif separa.

Rajah 1: Polariti boron trifluoride (BF3)
Unit Si untuk pengukuran momen dipole bon adalah coulomb-meter (c m). Molekul diatomik hanya mempunyai satu ikatan kovalen. Oleh itu, momen dipole ikatan molekul diatomik serupa dengan momen dipol molekul. Momen dipole molekul untuk molekul diatomik yang mengandungi dua atom serupa adalah sifar, i.e., momen molekul molekul cl2 adalah sifar. Tetapi sebatian yang sangat ionik seperti KBR mempunyai momen ikatan yang tinggi dan momen molekul. Untuk molekul polyatomik yang kompleks, terdapat banyak ikatan kovalen. Kemudian momen dipol molekul ditentukan oleh semua momen dipole bon individu.
Apa momen dipole?
Momen dipole adalah pemisahan caj elektrik. Pemisahan caj mungkin berlaku di antara dua ion dalam ikatan ionik atau dua atom dalam ikatan kimia kovalen. Momen dipole timbul kerana perbezaan antara nilai elektronegativiti atom yang berbeza yang membentuk ikatan kimia. Semakin besar perbezaan antara nilai elektronegativiti, lebih besar momen dipole. Momen dipol mengukur polariti molekul. Momen dipole molekul dikira menggunakan persamaan berikut.
μ = σq.r
di mana μ adalah momen dipole, q adalah magnitud caj dan r adalah kedudukan caj. Di sini, μ dan r adalah vektor, yang merupakan kuantiti yang mempunyai arah serta magnitud.
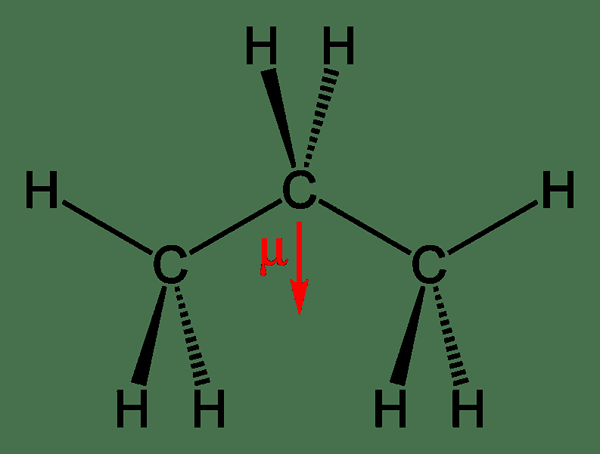
Rajah 2: Momen dipole propana
Tetapi kadang -kadang, istilah dipole momen digunakan untuk menamakan ukuran polaritas magnet sistem caj. Momen dipole magnet menentukan tork yang pengalaman magnet dalam medan magnet luaran. (Tork = momen; daya putaran).
Apakah momen ikatan persamaan dan momen dipole?
- Kedua -duanya digunakan untuk mengukur polariti (yang dibuat kerana pemisahan caj)
- Kedua-duanya diukur dalam unit Debye (d) yang sama dengan coulomb-meter (c m).
Apakah perbezaan antara momen bon dan momen dipole?
Momen bon vs momen dipole | |
| Momen bon adalah pemisahan caj elektrik dalam ikatan kimia kovalen yang terdapat dalam sebatian kimia tertentu. | Momen dipole adalah pemisahan caj elektrik. |
| Pengukuran | |
| Momen bon mengukur polariti ikatan kimia. | Momen dipol mengukur polariti ikatan kimia atau molekul. |
| Kejadian | |
| Momen bon berlaku dalam ikatan kimia kovalen. | Momen dipole berlaku di antara dua ion dalam ikatan ionik atau antara dua atom dalam ikatan kovalen dalam molekul. |
Ringkasan - Momen Bond vs Dipole Moment
Momen bon dan momen dipol adalah istilah yang berkaitan ketika datang kepada polaritas ikatan kimia dalam molekul atau sebatian ionik. Perbezaan utama antara momen bon dan momen dipol adalah bahawa momen ikatan berlaku dalam ikatan kimia kovalen manakala momen dipole berlaku di antara dua ion dalam ikatan ionik atau antara dua atom dalam ikatan kovalen.
Rujukan:
1. "Dipole momen."Kimia Libretexts, Libretexts, 16 Jan. 2018, boleh didapati di sini.
2. "Bond Dipole Moment."Wikipedia, Yayasan Wikimedia, 11 Mar. 2018, boleh didapati di sini.
Ihsan gambar:
1. "Polarity Boron Trifluoride" oleh Emma Farmer (Serephine di Bahasa Inggeris Wikipedia) - Dibuat dengan Adobe Photoshop oleh Emma Farmer (Domain Awam) melalui Commons Wikimedia
2. "Propane-Dipole-Moment-2D" oleh Ben Mills-Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


