Perbezaan antara entalpi ikatan dan entalpi kekisi
The Perbezaan utama antara entalpi ikatan dan entalpi kekisi ialah Enthalpy ikatan adalah jumlah tenaga yang diperlukan untuk memecahkan ikatan kimia, sedangkan tenaga kekisi adalah jumlah tenaga yang diperlukan untuk membentuk satu mole dari sebatian ionik dari kation dan anion dalam keadaan gas.
Kedua -dua istilah ini menggambarkan pertukaran tenaga antara sistem dan sekitarnya. Entalpi ikatan adalah bertentangan dengan entalpi kekisi. Entalpi bon menerangkan pemecahan bon sementara entalpi kisi menerangkan pembentukan bon. Inilah sebabnya mengapa mereka bertentangan dengan satu sama lain.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah entalpi bon
3. Apakah enthalpi kekisi
4. Perbandingan sampingan - entalpi ikatan vs entalpi kekisi dalam bentuk jadual
5. Ringkasan
Apakah entalpi bon?
Entalpi bon adalah jumlah tenaga yang diperlukan untuk memecahkan ikatan kimia. Jika kita menggunakan definisi standard di sini, ia mengatakan bahawa entalpi bon adalah perubahan entalpi apabila satu mol bon dipecahkan dalam bahan pada 298 k. Oleh kerana istilah ini berkaitan dengan pemecahan bon, kita boleh menamakannya sebagai tenaga pemisahan bon juga. Sinonim lain termasuk kekuatan bon dan purata tenaga bon.

Rajah 01: Tenaga bon beberapa ikatan kimia
Sekiranya nilai entalpi bon adalah tinggi, ini bermakna ikatan sangat kuat dan sukar untuk dipecahkan. Oleh itu, ia memerlukan lebih banyak tenaga untuk memecahkan ikatan tertentu. Biasanya, unit yang kami gunakan untuk penentuan nilai untuk entalpi bon adalah kcal/mol (kilocalories per mol) atau kJ/mol (kilojoule per mol).
Apakah enthalpi kekisi?
Entalpi kisi adalah jumlah tenaga yang diperlukan untuk membentuk satu tahi lalat sebatian ionik di bawah keadaan standard menggunakan kation dan anion dalam keadaan gas. Oleh kerana kita berurusan dengan kisi -kisi kristal di sini, istilah entalpi kekisi digunakan untuk kisi kristal; Dengan kata lain, ia digunakan untuk sebatian pepejal. Ini adalah ukuran daya yang mengikat ion bersama (kuasa kohesif).

Rajah 02: Struktur kisi
Umumnya, tenaga kekisi adalah penting dalam penentuan beberapa sifat fizikal, termasuk keterlarutan kristal, kekerasan dan turun naik. Biasanya, tenaga kekisi adalah tenaga negatif, tetapi entalpi kekisi adalah nilai positif. Ini kerana jumlah tahi lalat pepejal kristal berkurangan apabila membentuk kekisi.
Apakah perbezaan antara entalpi ikatan dan entalpi kekisi?
Entalpi bon adalah proses yang bertentangan dengan entalpi kekisi kerana entalpi bon berkaitan dengan pemecahan bon sementara entalpi kisi berurusan dengan pembentukan bon. Oleh itu, perbezaan utama antara entalpi entalpi dan kisi -kisi adalah bahawa entalpi ikatan adalah jumlah tenaga yang diperlukan untuk memecahkan ikatan kimia manakala tenaga kisi adalah jumlah tenaga yang diperlukan untuk membentuk satu mol sebatian ionik dari kation dan anion di keadaan gas. Entalpi ikatan adalah perubahan entalpi apabila satu mol bon dipecahkan dalam bahan pada 298 k. Oleh itu, kita boleh menyebutnya sebagai entalpi pemisahan bon juga.
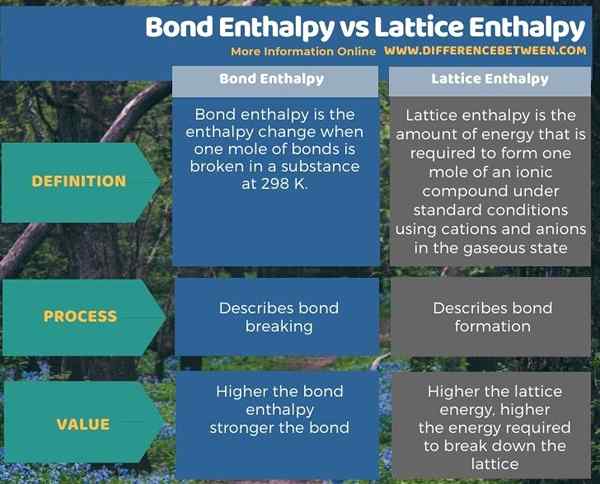
Ringkasan -Enthalpy Bond vs entalpi kekisi
Entalpi bon berurusan dengan pemecahan bon sementara entalpi kisi berurusan dengan pembentukan bon. Oleh itu, perbezaan utama antara entalpi entalpi dan kisi -kisi adalah bahawa entalpi ikatan adalah jumlah tenaga yang diperlukan untuk memecahkan ikatan kimia manakala tenaga kisi adalah jumlah tenaga yang diperlukan untuk membentuk satu mol sebatian ionik dari kation dan anion di keadaan gas.
Rujukan:
1. Helmenstine, Anne Marie. "Definisi entalpi bon dalam kimia."Thoughtco, Aug. 8, 2019, boleh didapati di sini.
2. "Tenaga Bon."Wikipedia, Yayasan Wikimedia, 4 Nov. 2019, boleh didapati di sini.
3. "Tenaga kekisi."Wikipedia, Yayasan Wikimedia, 11 Nov. 2019, boleh didapati di sini.
Ihsan gambar:
1. "Tenaga Bon" oleh CHEM540F09GRP8 - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia
2. "Natrium-klorida-3D-ionik" oleh Benjah-Bmm27 (Talk · Contribs)-Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


