Perbezaan antara asid binari dan asid polyatomik
The Perbezaan utama Antara asid binari dan asid polyatomik ialah Asid binari mengandungi atom dari hanya dua elemen kimia yang berbeza, sedangkan asid polyatomik mengandungi atom dari dua atau lebih unsur kimia yang berbeza.
Asid adalah sebatian kimia tak organik yang dapat meneutralkan bahan alkali. Asid dapat membubarkan kebanyakan logam. Kita dapat dengan mudah mengenal pasti asid menggunakan kertas litmus - litmus biru berubah menjadi warna merah apabila merendamnya dengan asid. Terdapat pelbagai jenis asid; Asid binari dan asid polyatomik adalah dua jenis.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah asid binari
3. Apakah asid polyatomik
4. Perbandingan sampingan - Asid binari vs asid polyatomik dalam bentuk jadual
5. Ringkasan
Apakah asid binari?
Asid binari adalah bahan bukan organik yang mempunyai terikat hidrogen dengan elemen kimia lain. Elemen kimia kedua ini kebanyakannya merupakan elemen bukan logam. Istilah "binari" merujuk kepada bahan yang mempunyai komponen "dua" sesuatu; Dalam konteks ini, ia adalah dua elemen kimia yang berbeza. Keasidan bahan -bahan ini timbul kerana keupayaan mereka melepaskan hidrogen sebagai kation atau proton, yang menyebabkan keasidan larutan akueusnya. Asid binari yang paling biasa termasuk asid hidrofluorik (HF), asid hidroklorik (HCL), dan asid hidrobromida (HBR). Selain itu, asid binari mungkin mempunyai satu atau lebih atom hidrogen setiap molekul, bergantung kepada valensi nonmetal yang terikat kepada atom hidrogen, e.g. H2S.
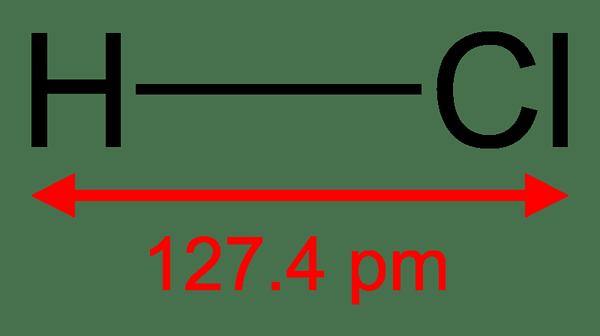
Rajah 01: hidrogen klorida
Asid binari boleh menjadi asid kuat, asid lemah atau sederhana berasid. Kekuatan berasid ini bergantung kepada kekuatan ikatan kovalen antara atom hidrogen dan atom bukan metal. Oleh kerana semua asid binari mengandungi atom hidrogen, nama asid binari bermula dengan "hidro-".
Apakah asid polyatomik?
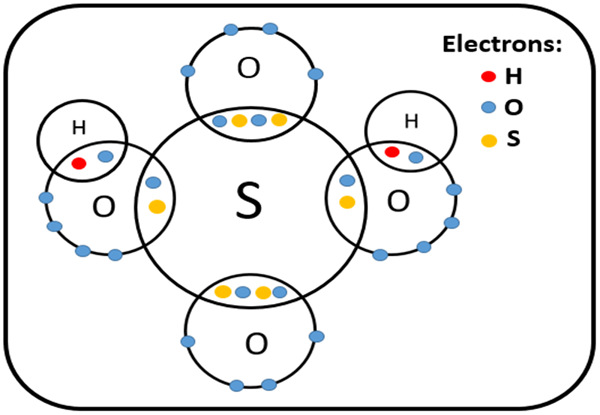
Asid polyatomik adalah sebatian bukan organik yang mengandungi atom dengan dua atau lebih elemen kimia yang berbeza. Walau bagaimanapun, ion -ion yang terbentuk dari pemisahan asid polyatomik boleh sama ada monoatomik atau polyatomik kerana beberapa asid polyatomik hanya mempunyai dua elemen kimia yang berbeza dan penyingkiran atom hidrogen membentuk ion monoatomik.

Rajah 02: Struktur asid sulfurik
Beberapa contoh asid polyatomik termasuk asid karbonik (H2CO3), asid sulfurik (H2SO4), asid sulfur (H2SO3), asid nitrik (HNO3), dan sebagainya.
Apakah perbezaan antara asid binari dan asid polyatomik?
Asid adalah bahan yang dapat meneutralkan bahan alkali. Perbezaan utama antara asid binari dan asid polyatomik ialah asid binari mengandungi atom dari hanya dua elemen kimia yang berbeza, sedangkan asid polyatomik mengandungi atom dari dua atau lebih unsur kimia yang berbeza.
Selain itu, asid binari selalu membentuk asas konjugasi monoatomik, sementara asid polyatomik dapat membentuk pangkalan konjugasi monoatomik atau pangkalan polyatomik. Juga, asid binari kebanyakannya kuat untuk asid sederhana. Asid hidrofluorik (HF), asid hidroklorik (HCl), dan asid hidrobromida (HBR) adalah beberapa contoh asid binari. Asid polyatomik, sebaliknya, boleh menjadi asid kuat, asid lemah atau sebatian berasid yang sederhana. Beberapa contoh termasuk asid karbonik (H2CO3), asid sulfurik (H2SO4), dan asid nitrik (HNO3).
Di bawah infographic tabulates bersebelahan perbezaan antara asid binari dan asid polyatomik.
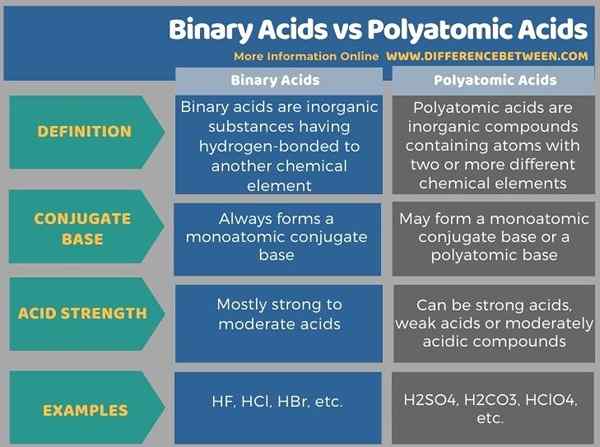
Ringkasan -Asid binari vs asid polyatomik
Kita boleh mengenal pasti asid dengan mudah menggunakan kertas litmus; litmus biru berubah menjadi merah apabila direndam dengan asid. Terdapat pelbagai jenis asid, seperti asid binari dan asid polyatomik. Perbezaan utama antara asid binari dan asid polyatomik ialah asid binari mengandungi atom dari hanya dua elemen kimia yang berbeza, sedangkan asid polyatomik mengandungi atom dari dua atau lebih unsur kimia yang berbeza.
Rujukan:
1. Helmenstine, Anne Marie. "Apa itu asid dan pangkalan?"Thoughtco, Aug. 26, 2020, boleh didapati di sini.
2. "5.9: Penamaan asid."Kimia Libretexts, Libretexts, 20 Nov. 2020, boleh didapati di sini.
Ihsan gambar:
1. "Hidrogen-chloride-2d-dimensi" (domain awam) melalui Wikimedia Commons
2. "H2SO4 Pic" oleh Jadder1224 - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia


