Perbezaan antara nombor kuantum azimut dan utama
The Perbezaan utama antara nombor kuantum azimuthal dan utama ialah Nombor kuantum azimut menggambarkan momentum sudut elektron dalam atom manakala nombor kuantum utama menggambarkan saiz orbital elektron.
Nombor kuantum adalah nilai yang penting dalam menggambarkan tahap tenaga atom. Terdapat empat nombor kuantum yang boleh kita gunakan untuk menggambarkan kedudukan elektron dalam atom. Mereka adalah nombor kuantum utama, nombor kuantum azimut, nombor kuantum magnet dan nombor kuantum putaran.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Berapakah nombor kuantum azimut
3. Apakah nombor kuantum utama
4. Perbandingan sampingan - nombor kuantum utama azimuthal vs dalam bentuk jadual
5. Ringkasan
Berapakah nombor kuantum azimut?
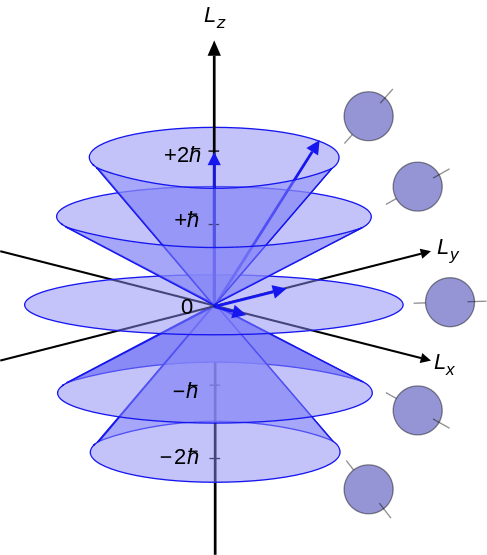
Nombor kuantum azimut adalah nombor kuantum yang menggambarkan momentum sudut elektron dalam atom. Oleh itu, kita juga boleh menyebutnya nombor kuantum momentum sudut orbital. Surat "L"Menunjukkan nombor kuantum azimut. Selain itu, nombor kuantum ini menentukan bentuk orbital di mana elektron wujud. Ia adalah yang kedua dari set empat nombor kuantum. Oleh itu, kita boleh menamakannya sebagai nombor kuantum kedua juga (kerana empat nombor kuantum menggambarkan keadaan kuantum elektron dalam atom). Persamaan yang boleh mengaitkan nombor kuantum azimut dengan momentum sudut adalah seperti berikut:
L2Ψ =h2L(L+1) ψ
Di mana l2 adalah pengendali momentum sudut orbital, ψ adalah fungsi gelombang elektron dan h adalah pemalar papan yang dikurangkan. Di sini, I selalu menjadi integer positif. Menurut mekanik kuantum, setiap tahap tenaga mempunyai subshells yang berbeza. Subshell ini berbeza antara satu sama lain dalam bentuk dan orientasi mereka. Subshells tahap tenaga dinamakan sebagai -I, 0 dan +L.
| Nombor azimut | Denotasi | Bilangan orbital | Bilangan maksimum elektron |
| 0 | s | 1 | 2 |
| 1 | p | 3 (= -1, 0, +1) | 6 |
| 2 | d | 5 (= -2, -1, 0, +1, +2) | 10 |
| 3 | f | 7 (= -3, -2, -1, 0, +1, +2, +3) | 14 |

Rajah 02: Nombor kuantum azimut dari -l, 0 hingga +l
Apakah nombor kuantum utama?
Nombor kuantum utama adalah nombor kuantum yang menggambarkan tahap tenaga utama di mana elektron wujud. Kita boleh menunjukkannya sebagai "n". Kerana ia adalah yang pertama dari empat nombor kuantum yang berbeza; kita juga boleh menyebutnya nombor kuantum pertama. Nilai nombor kuantum utama adalah integer positif bermula dari 1, i.e. n = 1, 2, 3, ..
Lebih tinggi nilai nombor kuantum utama, lebih tinggi tenaga elektron; Oleh itu, elektron longgar terikat pada atom. Maksudnya; Nilai "n" yang tinggi merujuk kepada tahap tenaga yang lebih tinggi. Selain itu, bagi setiap nilai "n", terdapat nilai berasingan untuk nombor kuantum azimut, nombor kuantum magnet dan nombor kuantum putaran. Ini kerana setiap tahap tenaga mempunyai subshells, orbital dan pasangan elektron sendiri, masing -masing.
Apakah perbezaan antara nombor kuantum azimut dan utama?
Nombor kuantum adalah nilai yang penting dalam menggambarkan tahap tenaga atom. Terdapat empat nombor kuantum yang berbeza, dan dua yang pertama adalah nombor kuantum utama dan nombor kuantum azimut. Perbezaan utama antara nombor kuantum azimut dan utama ialah nombor kuantum azimut menggambarkan momentum sudut elektron dalam atom, sedangkan nombor kuantum utama menerangkan saiz orbital elektron. Kita boleh menandakan nombor kuantum azimut sebagai "L"Dan nombor kuantum utama sebagai" n ".
Selain itu, nombor kuantum azimut menggambarkan momentum sudut dan bentuk orbital, sementara nombor kuantum utama menerangkan tahap tenaga di mana elektron wujud.
Di bawah infographic meringkaskan perbezaan antara nombor kuantum azimut dan utama.
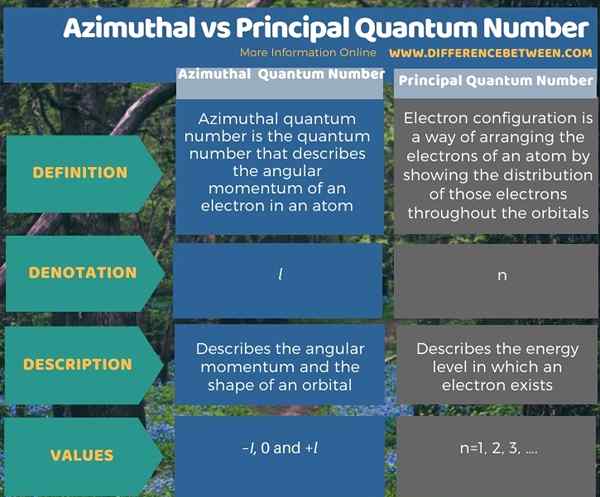
Ringkasan -nombor kuantum utama azimuthal vs
Nombor kuantum adalah nilai yang menggambarkan tahap tenaga atom. Terdapat empat nombor kuantum yang berbeza, dan dua yang pertama adalah nombor kuantum utama dan nombor kuantum azimut. Perbezaan utama antara nombor kuantum azimut dan utama ialah nombor kuantum azimut menggambarkan momentum sudut elektron dalam atom, sedangkan nombor kuantum utama menerangkan saiz orbital elektron.
Rujukan:
1. Helmenstine, Anne Marie. "Definisi nombor kuantum azimuthal."Pemikiran, Jun. 22, 2018, boleh didapati di sini.
2. Helmenstine, Anne Marie. "Definisi nombor kuantum utama."Thoughtco, Nov. 6, 2019, boleh didapati di sini.
Ihsan gambar:
1. "Model vektor momentum sudut orbital" oleh Maschen - Kerja sendiri (Domain Awam) melalui Commons Wikimedia


