Perbezaan antara argon dan oksigen
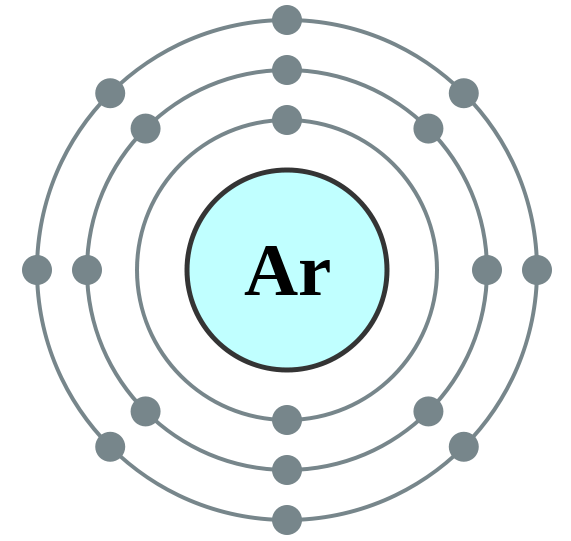
Perbezaan utama - argon vs. Oksigen
Argon dan oksigen adalah dua elemen kimia dalam jadual berkala. Mereka adalah kedua -dua unsur gas, di mana argon berada dalam keluarga gas mulia dan oksigen dari kumpulan chalcogen dalam jadual berkala. Argon adalah gas lengai manakala oksigen adalah gas yang sangat reaktif. Oksigen adalah salah satu unsur yang paling banyak di planet ini sementara Argon adalah salah satu gas mulia yang paling banyak. Argon dihasilkan apabila oksigen kesucian tinggi dihasilkan. Mereka mempunyai titik mendidih yang agak dekat, tetapi sifat kimia mereka sangat berbeza antara satu sama lain. Kerana anda dapat melihat perbezaan antara argon dan oksigen banyak. Artikel ini cuba memberi anda pemahaman yang jelas mengenai perbezaan.
Apa itu argon?
Argon (AR) adalah seorang ahli keluarga khas; Mereka dipanggil "jarang", "mulia" atau "lengai" gas. Semua gas dalam keluarga ini mempunyai kulit paling luar yang penuh dan kereaktifan kimia mereka hampir sifar. Argon adalah gas monatomi, tidak berwarna, tidak berbau, tidak enak dan tidak beracun. Argon sedikit larut dalam air. Kelimpahannya di atmosfera hampir 0.934% mengikut jumlah. Argon dianggap sebagai gas lengai yang paling banyak. Semua ahli keluarga Noble Gas memancarkan cahaya apabila mereka teruja elektrik; Dalam kes ini argon menghasilkan cahaya violet biru pucat.
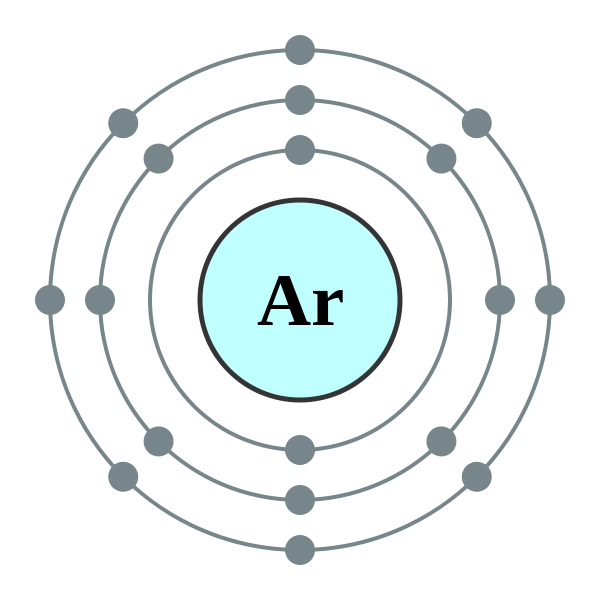
Apa itu oksigen?
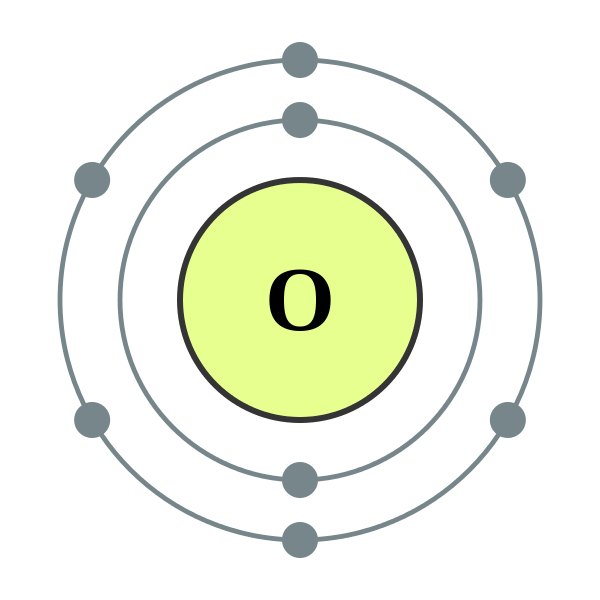
Oksigen boleh dianggap sebagai salah satu elemen yang paling banyak di bumi. Kira -kira 21% oksigen unsur bebas hadir di atmosfera kita. Di samping itu, ia digabungkan dengan sebatian lain seperti air dan mineral. Malah fungsi badan manusia kita menggunakan oksigen dan ia mengandungi 65% oksigen oleh jisim. Oksigen secara semulajadi berlaku sebagai molekul gas diatomik, o2 (g). Ia adalah gas yang tidak berwarna, tidak enak dan tidak berbau dengan sifat kimia dan fizikalnya yang unik. Ketumpatan oksigen lebih besar daripada udara dan mempunyai kelarutan yang sangat rendah di dalam air.
Kereaktifan kimia oksigen sangat tinggi; Ia bertindak balas dengan hampir semua elemen di bawah keadaan yang berbeza, kecuali gas mulia dan beberapa logam reaktif kurang. Oksigen adalah elemen paling reaktif di sebelah fluorin (F).
Apakah perbezaan antara argon dan oksigen?
Sifat:
| Harta | Argon | Oksigen |
| Nombor atom | 18 | 8 |
| Konfigurasi Elektronik | 1S² 2S² 2p63S² 3p⁶ | 1S² 2S² 2p⁴ |
| Takat didih | -185.9 ° C (-302.6 ° F) | -182 ° C (-297 ° F) |
| Takat lebur | -189 ° C (-308 ° F) | -218 ° C (-361 ° F) |
Berat:
Argon: Argon adalah 1.4 kali lebih berat seperti udara; ia tidak bernafas sebagai oksigen dan boleh menyebabkan sesekali dengan menetapkan di bahagian bawah di paru -paru.
Oksigen: Oksigen juga lebih padat daripada udara, tetapi ia adalah gas berat ringan yang bernafas.
Kegunaan:
Argon: Argon adalah gas lengai walaupun pada suhu tinggi, dan atas sebab ini, ia digunakan dalam beberapa proses perindustrian kritikal seperti dalam pembuatan keluli tahan karat berkualiti tinggi dan dalam menghasilkan kristal silikon bebas kekotoran untuk semikonduktor. Ia digunakan secara meluas sebagai gas pengisi lengai dalam mentol lampu. Ia tetap tidak reaktif walaupun mentol dipanaskan hingga suhu tinggi.
Oksigen: Oksigen digunakan secara meluas dalam industri logam dengan asetilena dan gas bahan api lain untuk pemotongan logam, kimpalan, lebur, pengerasan, selendang, dan pembersihan. Air yang diperkaya oksigen atau oksigen digunakan dalam pembuatan keluli dan besi, dalam proses penapisan kimia dan pemanasan untuk menghilangkan karbon, dan dalam reaksi pengoksidaan.
Industri petroleum juga menggunakan oksigen secara meluas sebagai makanan untuk bertindak balas dengan hidrokarbon untuk menghasilkan bahan kimia seperti aldehid dan alkohol.
Ihsan gambar:
1. Elektron Shell 018 Argon - Tiada Label oleh Commons: Pengguna: Pumbaa (Kerja Asal oleh Commons: Pengguna: Greg Robson) [CC BY -SA 2.0], melalui Wikimedia Commons
2. Elektron Shell 008 Oksigen (Diatomic Nonmetal) - Tiada label oleh Depiep (kerja sendiri) [CC BY -SA 3.0], melalui Wikimedia Commons


