Perbezaan antara actinides dan lanthanides
The Perbezaan utama antara actinides dan lanthanides adalah bahawa actinides mengisi elektron ke sub-orbital 5F, sedangkan lanthanides mengisi elektron sehingga sub-orbital.
Lanthanides dan actinides berlaku dalam dua baris berasingan dalam jadual berkala. Oleh itu, kedua -duanya tergolong dalam blok F. Kerana mereka mempunyai elektron paling luar mereka di orbital f. Oleh itu, kita boleh menamakannya sebagai elemen blok f.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu actinides
3. Apa itu lanthanides
4. Perbandingan sampingan - actinides vs lanthanides dalam bentuk jadual
5. Ringkasan
Apa itu actinides?
Actinides adalah satu set elemen dalam jadual berkala dengan nombor atom antara 90 hingga 103. Sehubungan itu, terdapat 14 elemen logam termasuk berikut:
- thorium th (z = 90)
- Protactinium PA (91)
- Uranium u (92)
- Nptunium NP (93)
- Plutonium PU (94)
- Americium am (95)
- Curium CM (96)
- Berkelium BK (97)
- Californium CF (98)
- Einsteinium ES (99)
- Fermium FM (100)
- Mendelevium MD (101)
- unit ї 102
- Lawrencium LR (103).
Kami namakan mereka sebagai unsur blok F; kerana elektron akhir mereka berada dalam sub-orbital F. Semua actinides tidak stabil; Oleh itu, semuanya radioaktif. Oleh kerana mereka adalah logam, mereka sangat elektropositif. Selain itu, mereka adalah logam padat, dan banyak allotropes hadir. Logam ini mudah mencemarkan di udara dan bertindak balas dengan air mendidih atau cairkan asid melepaskan gas hidrogen.

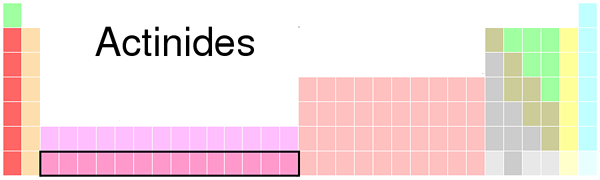
Rajah 01: Lokasi actinide dalam jadual berkala
Seperti logam lain, mereka juga boleh membentuk sebatian dengan elemen bukan logam. Tambahan pula, kita dapat mencari actinides dalam persekitaran semula jadi, walaupun ada yang sangat jarang berlaku. Sebagai contoh, uranium dan torium hadir sebagai deposit, di Kanada. Oleh kerana radioaktiviti mereka, kebanyakan actinides berguna dalam pengeluaran tenaga nuklear. Kita boleh menghasilkan unsur actinide secara sintetik untuk menggunakannya untuk pelbagai tujuan. Selain itu, sesetengah daripada mereka berguna untuk tujuan perubatan, pengenalan mineral, radiografi neutron, dan lain -lain.
Apa itu lanthanides?
Lanthanides mengandungi unsur -unsur dari nombor atom 57 hingga 71. Terdapat 15 elemen logam. Unsur -unsur ini termasuk berikut:
- Lanthanum LA (57)
- Cerium CE (58)
- Praseodymium PR (59)
- Neodymium ND (60)
- PM Promethium (61)
- Samarium SM (62)
- Europium EU (63)
- Gadolinium GD (64)
- Terbium TB (65)
- Disprosium DY (66)
- Holmium Ho (67)
- yttrium er (68)
- Thulium TM (69)
- ytterbium yb (70)
- Lutetium Lu (71).
Ini tergolong dalam blok F dalam jadual berkala; Oleh itu, elektron akhir mengisi sub-orbital 4F. Di sana, sub-orbital lain meliputi orbital 4F, dan kimia lanthanides berbeza kerana saiz atom. Mereka menunjukkan +3 keadaan pengoksidaan. Selanjutnya, dari kiri ke kanan berturut -turut dalam jadual berkala, saiz +3 ion lanthanide berkurangan, dan kami panggil ini sebagai penguncupan lanthanide.
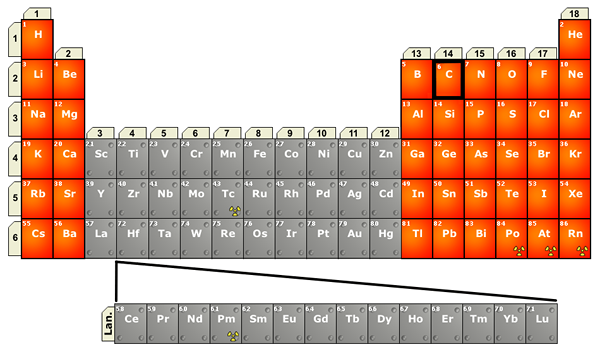
Rajah 02: Lokasi lanthanides dalam jadual berkala
Selain itu, lanthanides adalah logam warna perak, yang bertindak balas dengan mudah dengan oksigen di udara untuk menghasilkan oksida mereka. Ini adalah logam yang sangat reaktif, agak lembut dengan titik lebur yang tinggi dan titik mendidih. Juga, mereka mudah membentuk sebatian ionik dengan bukan logam. Apabila bertindak balas dengan asid cair atau lanthanides air menghasilkan gas hidrogen.
Selain itu, unsur -unsur ini mempunyai elektron yang tidak berpasangan (kecuali lutetium), yang bertanggungjawab terhadap sifat paramagnetik mereka. Lebih -lebih lagi, kita namakan mereka sebagai logam nadir bumi kerana kelimpahan rendah di permukaan bumi. Walaupun mereka jarang berlaku, terdapat banyak penggunaan dari unsur -unsur ini. Oleh itu, mereka berguna sebagai pemangkin dalam pengeluaran kaca, petroleum, dll. Selanjutnya, mereka berguna dalam magnet, fosfor, lampu, superkonduktor, aplikasi optoelektronik, dll.
Apakah perbezaan antara actinides dan lanthanides?
Actinides adalah satu set elemen dalam jadual berkala dengan nombor atom antara 90 hingga 103 manakala lanthanides adalah satu set elemen dalam jadual berkala dengan nombor atom 57 hingga 71. Perbezaan utama antara actinides dan lanthanides adalah bahawa actinides mengisi elektron ke sub-orbital 5F, sedangkan lanthanides mengisi elektron sehingga sub-orbital 4F. Selain itu, semua actinides adalah radioaktif, tetapi lanthanides tidak (kecuali promethium). Sebagai satu lagi perbezaan antara actinides dan lanthanides, kita boleh mengatakan bahawa lanthanides menunjukkan keadaan pengoksidaan maksimum +4 manakala actinides menunjukkan +3, +4, +5, +6 dan +7 keadaan pengoksidaan.
Di bawah infographic membentangkan ringkasan perbandingan perbezaan antara actinides dan lanthanides.

Ringkasan -Actinides vs lanthanides
Actinides adalah satu set elemen dalam jadual berkala dengan nombor atom antara 90 hingga 103 manakala lanthanides adalah satu set elemen dalam jadual berkala dengan nombor atom 57 hingga 71. Oleh itu, perbezaan utama mereka wujud dalam konfigurasi elektron mereka. Oleh itu, perbezaan utama antara actinides dan lanthanides ialah actinides mengisi elektron ke sub-orbital 5F, sedangkan lanthanides mengisi elektron sehingga sub-orbital 4F.
Rujukan:
1. Libretexts. "Lanthanides: sifat dan reaksi."Kimia Libretexts, Yayasan Sains Kebangsaan, 26 Nov. 2018. Terdapat di sini
2. Libretexts. "The Actinides."Kimia Libretexts, Yayasan Sains Kebangsaan, 26 Nov. 2018. Terdapat di sini
Ihsan gambar:
1."Actinide-Jable" (CC BY-SA 3.0) melalui Commons Wikimedia
2."ORGCHEM MAINGRP METALS OF MINETINGDPSDIVED" oleh LEPROF 7272 - Kerja sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia


