Perbezaan antara titrasi asid dan titrasi redoks
Perbezaan utama -titrasi asid vs vs. Titrasi redoks
Secara umum, titrasi digunakan untuk menentukan kepekatan penyelesaian yang tidak diketahui (analit). Kaedah titrimetrik yang paling biasa digunakan ialah titrasi asid dan titrasi redoks. The Perbezaan utama antara titrasi asid dan titrasi redoks adalah sifat tindak balas yang berlaku antara titran dan analit dalam titrasi. Dalam titrasi asas asid, tindak balas peneutralan berlaku dan dalam titrasi redoks, tindak balas redoks berlaku (tindak balas pengoksidaan dan tindak balas pengurangan). Penggunaan petunjuk adalah kaedah yang paling biasa digunakan untuk menentukan titik akhir reaksi.
Apakah titrasi asid-asas?
Dalam titrasi asid-asas, asid (titrasi berasid) atau asas (titrasi asas) digunakan sebagai titran. Contoh asid yang digunakan dalam titrasi berasid ialah h2Jadi4, Hcl, atau hno3. Kebanyakan titran asas yang digunakan ialah NaOH, k2Co3 atau na2Co3. Titrasi asas asid dapat diklasifikasikan seperti berikut bergantung pada kekuatan asid dan pangkalannya.
- Asid kuat - Titrasi asas yang kuat
- Asid kuat- titrasi asas lemah
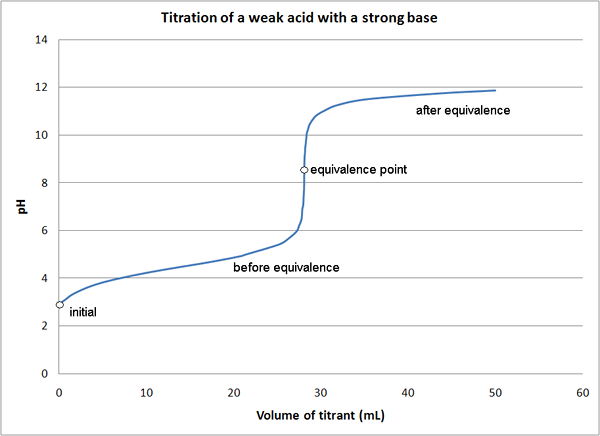
- Asid lemah - titrasi asas yang kuat
- Asid lemah - titrasi asas lemah
Dalam kebanyakan titrasi asid-asas, petunjuk digunakan untuk menentukan titik akhir reaksi. Petunjuk yang berbeza digunakan bergantung pada jenis titrasi seperti yang disebutkan di atas.

Apa itu titrasi redoks?
Titrasi redoks melibatkan tindak balas redoks. Reaksi redoks mempunyai dua reaksi; tindak balas pengoksidaan dan tindak balas pengurangan. Kedua -dua proses pengoksidaan dan pengurangan berlaku pada masa yang sama di mana membolehkan kita menentukan penyelesaian reaksi. Ini juga dikenali sebagai titik akhir titrasi. Ini boleh ditentukan dalam beberapa cara; Menggunakan elektrod penunjuk, penunjuk redoks (penunjuk menghasilkan warna yang berbeza pada keadaan pengurangan pengoksidaan), dan penunjuk bukan Redoks (penunjuk menghasilkan warna apabila jumlah titran yang berlebihan ditambah).

Apakah perbezaan antara titrasi asid dan titrasi redoks?
Sifat reaksi:
Titrasi Asid-Asid: Titrasi asas asid melibatkan tindak balas peneutralan antara analit (penyelesaian dengan kepekatan yang tidak diketahui) dan titran berasid atau asas.
Titrasi redoks: Reaksi redoks melibatkan tindak balas pengoksidaan dan pengurangan antara analit dan titran. Tidak ada peraturan yang mengoksidakan komponen dan yang mana yang dikurangkan. Sama ada analit atau pengoksidaan titran, dan komponen yang tinggal dikurangkan dengan sewajarnya.
Penentuan titik akhir:
Titrasi Asid-Asid: Secara umum, penunjuk pH, meter pH atau meter konduktansi digunakan untuk menentukan titik akhir titrasi asas asid.
Titrasi redoks: Kaedah yang paling biasa digunakan untuk menentukan titik akhir tindak balas redoks menggunakan potentiometer atau penunjuk redoks. Tetapi, paling kerap sama ada analit atau titran menghasilkan warna di titik akhir. Jadi, petunjuk tambahan tidak diperlukan dalam kes tersebut.
Contoh:
Titrasi Asid-Asid:
| Jenis | Tindak balas (penunjuk) |
| Asid kuat - Titrasi asas yang kuat | Hcl + Naohànacl + H2O (phenolphthalein /metil oren) |
| Asid kuat - titrasi asas lemah | HCl + NH3à nh3CL (metil oren) |
| Asid lemah - titrasi asas yang kuat | Ch3Cooh + naohà ch3Coona + h2O (phenolphthalein) |
| Titrasi asas asid lemah | Ch3COOH + NH3àch3COO-+NH4+(Tiada petunjuk yang sesuai) |
Titrasi redoks:
2 kmno4 + 5 jam2C2O4 + 6 HCl → 2 mncl2 + 2kcl + 10 co2 + 8 jam2O
(+7) (+3) (+2) (+4)
Dalam tindak balas di atas, permanganat dikurangkan sementara asid oksida dioksidakan. Apabila tindak balas selesai, warna ungu permanganat berubah menjadi tidak berwarna.
Kmno4 + 5fecl2 +8HCL → 5fecl3+Mncl2+KCl+4H2O
(+7) (+2) (+3) (+2)
Ihsan gambar:
1. Titrasi asid lemah dengan asas yang kuat oleh kuantumkinetik (kerja sendiri) [cc oleh 3.0], melalui Wikimedia Commons
2. "Winkler Titration Sebelum Titrasi" oleh Willwood [CC BY-SA 3.0] melalui Commons


