Perbezaan antara orbital 1s dan 2s

Perbezaan utama - orbital 1s vs 2s
Atom adalah unit perkara terkecil. Dengan kata lain, semua perkara dibuat daripada atom. Atom terdiri daripada zarah subatomik, terutamanya, proton, elektron, dan neutron. Proton dan elektron membuat nukleus, yang terletak di tengah atom. Tetapi elektron diposisikan di orbital (atau tahap tenaga) yang terletak di luar nukleus atom. Ia juga penting untuk diperhatikan bahawa orbital adalah konsep hipotetikal yang digunakan untuk menjelaskan lokasi atom yang paling mungkin. Terdapat pelbagai orbital yang mengelilingi nukleus. Terdapat juga sub-orbital seperti s, p, d, f, dll. Sub-orbital S berbentuk sfera apabila dianggap sebagai struktur 3D. Orbital s mempunyai kebarangkalian tertinggi mencari elektron di sekitar nukleus. Sub-orbital sekali lagi bernombor sebagai 1s, 2s, 3s, dll. Menurut tahap tenaga. Perbezaan utama antara orbital 1s dan 2 adalah tenaga setiap orbit. Orbital 1s mempunyai tenaga yang lebih rendah daripada orbital 2s.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu orbital 1s
3. Apa itu orbital 2s
4. Perbandingan sampingan - 1s vs 2s orbital
5. Ringkasan
Apa itu orbital 1s?
1s orbital adalah orbital yang paling dekat dengan nukleus. Ia mempunyai tenaga terendah di antara orbital lain. Ia juga bentuk sfera terkecil. Oleh itu, jejari orbital s kecil. Terdapat hanya 2 elektron di orbital s. Konfigurasi elektron boleh ditulis sebagai 1s1, Sekiranya terdapat hanya satu elektron di orbital s. Tetapi jika ada sepasang elektron, ia boleh ditulis sebagai 1s2. Kemudian kedua -dua elektron dalam langkah orbital s ke arah yang bertentangan kerana penolakan yang berlaku kerana caj elektrik yang sama dari kedua -dua elektron. Apabila terdapat elektron yang tidak berpasangan, ia dipanggil paramagnetik. Itu kerana ia dapat tertarik dengan magnet. Tetapi jika orbital diisi dan sepasang elektron hadir, elektron tidak dapat ditarik oleh magnet; Ini dikenali sebagai Diamagnetic.
Apa itu orbital 2s?
Orbital 2s lebih besar daripada orbital 1s. Oleh itu, jejarinya lebih besar daripada orbital 1s. Ia adalah orbital almari seterusnya untuk nukleus selepas orbital 1s. Tenaga itu lebih tinggi daripada orbital 1s tetapi lebih rendah daripada orbital lain dalam atom. 2S Orbital juga boleh diisi hanya dengan satu atau dua elektron. Tetapi 2s orbital dipenuhi dengan elektron hanya setelah selesai orbital 1s. Ini dipanggil prinsip aufbau, yang menunjukkan susunan elektron mengisi ke dalam sub-orbital.
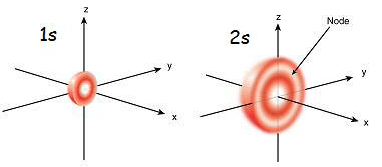
Rajah 01: 1s dan 2s orbital
Apakah perbezaan antara orbital 1s dan 2s?
1s vs 2s orbital | |
| Orbital 1s adalah orbital terdekat dengan nukleus. | 2S Orbital adalah orbital terdekat kedua untuk nukleus. |
| Tahap tenaga | |
| Tenaga orbital 1s lebih rendah daripada 2s orbital. | 2s mempunyai tenaga yang lebih tinggi. |
| Jejari orbital | |
| Jejari orbital 1s lebih kecil. | Jejari orbital 2s agak besar. |
| Saiz orbital | |
| 1s orbital mempunyai bentuk sfera terkecil. | 2s orbital lebih besar daripada orbital 1s. |
| Pengisian elektron | |
| Elektron pertama kali diisi dalam orbital 1s. | Orbital 2s diisi hanya setelah selesai elektron dalam orbit 1s. |
Ringkasan -Orbital 1s vs 2s
Atom adalah struktur 3D yang mengandungi nukleus di pusat yang dikelilingi oleh orbital berbentuk pelbagai tahap tenaga yang berbeza. Orbital ini sekali lagi dibahagikan kepada sub-orbital mengikut sedikit perbezaan tenaga. Elektron, yang merupakan zarah subatomik utama atom terletak di tahap tenaga ini. Sub-orbital 1s dan 2s adalah yang paling dekat dengan nukleus. Perbezaan utama antara orbital 1s dan 2s adalah perbezaan tahap tenaga mereka, iaitu, 2s orbital adalah tahap tenaga yang lebih tinggi daripada 1s orbital.
Rujukan:
1. Libretexts. "Orbital atom."Kimia Libreetexts. Libretexts, 03 Nov. 2015. Web. 26 Mei 2017. .
2. Atom, elektron dan orbital. N.p., n.d. Web. 26 Mei 2017. .
Ihsan gambar:
1. "S orbital" (dipotong) oleh Yayasan CK -12 - Fail: Kimia Sekolah Tinggi.PDF, Page 265 (CC BY-SA 3.0) melalui Commons Wikimedia


