Perbezaan antara SO2 dan SO3
The Perbezaan utama Antara So2 dan So3 ialah Jadi2 adalah gas tidak berwarna pada suhu bilik, sedangkan begitu3 adalah pepejal kristal putih tanpa warna.
Jadi2 Adakah sulfur dioksida sementara itu3 adalah sulfur trioksida. Kedua -duanya adalah oksida sulfur.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu SO2
3. Apa itu So3
4. Perbandingan sampingan - SO2 vs SO3 dalam bentuk jadual
5. Ringkasan
Apa itu SO2?
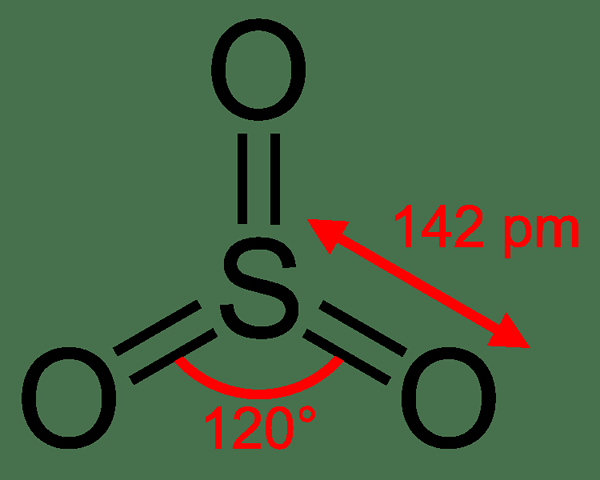
Jadi2 adalah sulfur dioksida. Ia adalah sebatian gas tanpa warna yang mengandungi atom sulfur dan oksigen. Jadi2 adalah formula kimia sebatian ini. Oleh itu, ia mengandungi atom sulfur yang terikat kepada dua atom oksigen melalui ikatan kovalen. Satu atom oksigen boleh membentuk ikatan berganda dengan atom sulfur. Oleh itu, atom sulfur adalah atom pusat kompaun. Atom sulfur mempunyai 6 elektron di orbital paling luarnya. Oleh itu selepas membentuk dua ikatan berganda dengan atom oksigen, terdapat dua lagi elektron yang tinggal; elektron ini wujud sebagai pasangan elektron tunggal.
Oleh itu, kita dapat menentukan geometri SO2 molekul; ia adalah geometri sudut. Jadi2 adalah kutub kerana geometrinya (sudut) dan kehadiran pasangan elektron tunggal.
Rajah 01: Struktur sulfur dioksida
Sulfur dioksida dianggap sebagai gas toksik. Oleh itu, jika terdapat SO2 di atmosfera, ia akan menjadi petunjuk pencemaran udara. Juga, gas ini mempunyai bau yang sangat menjengkelkan. Jisim molekul sulfur dioksida adalah 64 g/mol. Ia adalah gas tanpa warna pada suhu bilik. Titik lebur adalah kira -kira -71 ° C, sedangkan titik mendidih ialah -10 ° C.
Keadaan pengoksidaan sulfur dalam sulfur dioksida adalah +4. Oleh itu, sulfur dioksida juga boleh dihasilkan oleh pengurangan sebatian yang terdiri daripada atom sulfur yang berada dalam keadaan pengoksidaan yang lebih tinggi. Salah satu contohnya ialah tindak balas antara asid tembaga dan sulfurik. Di sini, sulfur dalam asid sulfurik berada dalam keadaan pengoksidaan +6. Oleh itu, ia dapat dikurangkan kepada keadaan pengoksidaan +4 sulfur dioksida.
Sulfur dioksida boleh digunakan dalam pengeluaran asid sulfurik, yang mempunyai sejumlah aplikasi dalam skala perindustrian dan skala makmal. Sulfur dioksida juga ejen pengurangan yang baik. Oleh kerana keadaan pengoksidaan sulfur adalah +4 dalam sulfur dioksida, ia boleh dioksidakan dengan mudah ke keadaan pengoksidaan +6, yang membolehkan sebatian lain dikurangkan.
Apa itu So3?
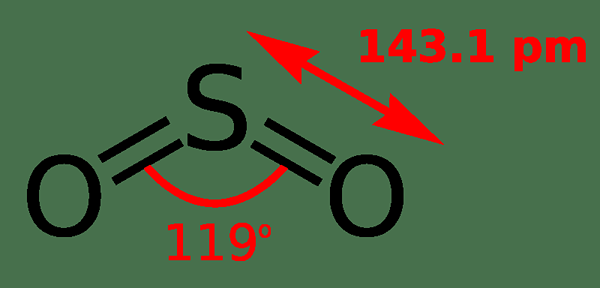
Jadi3 adalah sulfur trioksida. Ia adalah sebatian pepejal yang mengandungi satu atom sulfur yang mengikat dengan tiga atom oksigen. Jadi3 adalah formula kimia sebatian ini. Di sini, setiap atom oksigen mempunyai ikatan berganda dengan atom sulfur. Atom sulfur berada di tengah -tengah molekul. Atom sulfur mempunyai 6 elektron di orbital paling luarnya. Oleh itu, selepas membentuk tiga ikatan berganda dengan atom oksigen, tidak ada lagi elektron yang tinggal pada atom sulfur seperti dalam sulfur dioksida. Oleh itu, ini menentukan geometri SO3 molekul; ia mempunyai geometri planar trigonal. Jadi3 bukan polar kerana geometrinya (planar trigonal) dan ketiadaan pasangan elektron tunggal.

Rajah 02: Geometri sulfur trioksida
Jisim molekul sulfur trioksida adalah 80.057 g/mol. Titik lebur SO3 adalah kira -kira 16.9 ° C, sedangkan titik mendidih ialah 45oC. Pada suhu dan tekanan bilik, sulfur trioksida adalah sebatian pepejal kristal putih yang akan dirasakan di udara. Ia mempunyai bau pedas. Keadaan pengoksidaan sulfur dalam sulfur trioksida adalah +6.
Dalam bentuk gasnya, sulfur trioksida adalah bahan pencemar udara dan merupakan komponen utama dalam hujan asid. Walau bagaimanapun, sulfur trioksida sangat penting dalam pengeluaran asid sulfurik dalam skala perindustrian. Kerana sulfur trioksida adalah bentuk anhidrida asid sulfurik.
Jadi3 (l) + H2O(l) → h2Jadi4 (l)
Reaksi di atas sangat pesat dan eksotermik. Oleh itu, kaedah kawalan harus digunakan apabila menggunakan sulfur trioksida untuk pengeluaran asid sulfurik industri. Selain itu, sulfur trioksida adalah reagen penting dalam proses sulfonasi.
Apakah perbezaan antara SO2 dan SO3?
Jadi2 Adakah sulfur dioksida sementara itu3 adalah sulfur trioksida. Kedua -duanya adalah oksida sulfur. Perbezaan utama antara SO2 dan SO3 adalah begitu2 adalah gas tidak berwarna pada suhu bilik, sedangkan begitu3 adalah pepejal kristal putih tanpa warna. Tambahan pula, keadaan pengoksidaan sulfur dalam sulfur dioksida adalah +4 manakala dalam sulfur trioksida ia adalah +6. Oleh kerana kehadiran pasangan elektron tunggal dan geometri mereka, sulfur dioksida adalah sebatian kutub, manakala sulfur trioksida adalah sebatian nonpolar. Infographic berikut meringkaskan perbezaan antara SO2 dan SO3.

Ringkasan -SO2 vs SO3
Jadi2 adalah sulfur dioksida, dan begitu3 adalah sulfur trioksida. Kedua -duanya adalah oksida sulfur. Perbezaan utama antara SO2 dan SO3 adalah begitu2 adalah gas tidak berwarna pada suhu bilik, sedangkan begitu3 adalah pepejal kristal putih tanpa warna.
Rujukan:
1. Brandt, Malcolm J., et al. "Penyimpanan kimia, dos dan kawalan."Bekalan Air Tworts, 2017, pp. 513-552., doi: 10.1016/B978-0-08-100025-0.00012-0.
Ihsan gambar:
1. "Sulfur-dioksida-2d" oleh pemuat naik asal adalah Richtom80 di Wikipedia Bahasa Inggeris. - Dipindahkan dari en.Wikipedia ke Commons (Domain Awam) melalui Commons Wikimedia
2. "Sulfur-TRIOXIDE-2D-DIMENSIONS" oleh JYNTO-Kerja sendiri, berdasarkan fail: Sulfur-Trioxide-2D-dimensi.PNG (Domain Awam) melalui Wikimedia Commons


