Perbezaan antara molekul kutub dan dipolar
The Perbezaan utama Antara molekul kutub dan dipolar ialah Molekul kutub mempunyai dua hujung bertentangan dengan caj elektrik yang bertentangan, sedangkan molekul dipolar mempunyai dua tiang.
Umumnya, kita boleh menggunakan istilah kutub dan dipolar secara bergantian kerana kedua -dua istilah ini menggambarkan satu molekul tunggal yang mempunyai dua hujung bertentangan. Hujung yang berbeza ini timbul kerana perbezaan pengedaran elektron sepanjang molekul.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah molekul kutub
3. Apakah molekul dipolar
4. Perbandingan sampingan - molekul polar vs dipolar dalam bentuk jadual
5. Ringkasan
Apakah molekul kutub?
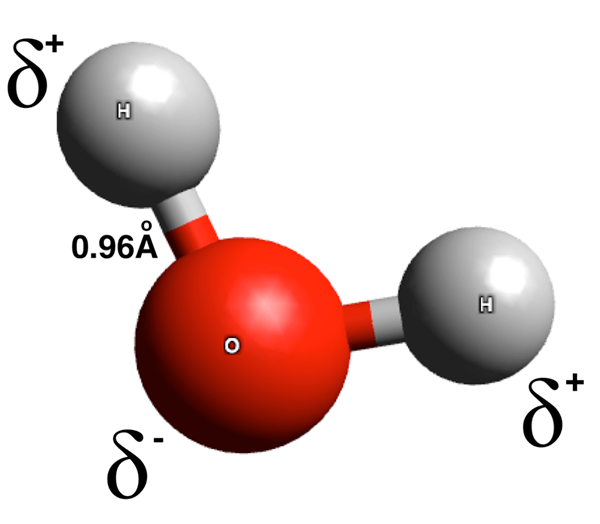
Molekul kutub adalah spesies kimia yang mempunyai ikatan kutub. Jumlah momen dipole ikatan kutub ini tidak sama dengan sifar. Ikatan kutub mempunyai akhir yang dibebankan secara positif dan akhir yang dibebankan sebahagiannya negatif. Caj elektrik ini timbul disebabkan oleh perbezaan dalam taburan elektron sepanjang ikatan kimia. Perbezaan pengedaran elektron adalah hasil daripada perbezaan nilai elektronegativiti atom dalam ikatan kimia. Di sini, atom elektronegatif lebih menarik elektron pasangan elektron ikatan ke arah dirinya sendiri, yang memberikan atom ini sebagai caj negatif separa. Oleh itu, atom lain dalam ikatan ini mendapat caj positif separa kerana kekurangan ketumpatan elektron di sekelilingnya, yang mendedahkan caj positif proton dalam nukleus atom.

Rajah 01: Pemisahan caj dalam molekul air
Selain itu, molekul kutub boleh terbentuk apabila susunan ruang molekul (geometri) membuat caj positif berkumpul di satu sisi molekul dan caj negatif di seberang. Beberapa contoh molekul poplar yang biasa termasuk air, ammonia, etanol, sulfur dioksida, dan hidrogen sulfida.
Apakah molekul dipolar?
Molekul dipolar adalah spesies kimia yang mempunyai dua tiang dalam molekul yang sama. Momen dipol berlaku apabila terdapat pemisahan dalam caj elektrik akibat pengagihan elektron yang tidak rata di seluruh molekul. Momen dipol berlaku disebabkan oleh perbezaan nilai elektronegativiti atom dalam molekul. Tidak seperti sebatian kutub, molekul dipolar adalah neutral elektrik (caj elektrik keseluruhan molekul adalah sifar). Ini kerana pemisahan caj molekul menunjukkan nilai yang sama dengan cas elektrik dengan orientasi yang bertentangan, yang membatalkan satu sama lain; Oleh itu, tidak ada caj bersih.
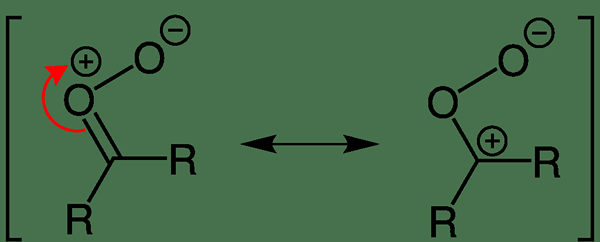
Rajah 02: Delocalization cas elektrik dalam oksida karbonil
Dalam kebanyakan molekul dipolar, caj tersebut diselaraskan sepanjang molekul. Beberapa contoh termasuk karbonil oksida, diazometana, fosfonium ylide, dan lain -lain.
Apakah perbezaan antara molekul kutub dan dipolar?
Perbezaan utama antara molekul kutub dan dipolar ialah molekul kutub mempunyai dua hujung bertentangan dengan caj elektrik yang bertentangan, sedangkan molekul dipolar mempunyai dua tiang. Walau bagaimanapun, secara umum, kita boleh menggunakan istilah kutub dan dipolar secara bergantian kerana kedua -dua istilah ini menerangkan satu molekul yang mempunyai dua hujung bertentangan.
Selain itu, satu lagi perbezaan yang signifikan antara molekul kutub dan dipolar ialah molekul kutub membentuk apabila terdapat pemisahan caj manakala molekul dipolar terbentuk kerana perbezaan nilai elektronegativiti atom.
Berikut adalah tabulasi ringkasan perbezaan antara molekul kutub dan dipolar.

Ringkasan - Molekul Polar vs Dipolar
Ringkasnya, kita boleh menggunakan istilah kutub dan kutub secara bergantian kerana kedua -dua istilah ini menggambarkan satu molekul tunggal yang mempunyai dua hujung bertentangan. Perbezaan utama antara molekul kutub dan dipolar ialah molekul kutub mempunyai dua hujung bertentangan dengan caj elektrik yang bertentangan, sedangkan molekul dipolar mempunyai dua tiang.
Rujukan:
1. "13.3: Momen polariti dan momen dipole."Kimia Libreetexts, Libretexts, 3 Jun 2019, boleh didapati di sini.
2. "Kompaun Dipolar."Wikipedia, Yayasan Wikimedia, 13 Julai 2018, boleh didapati di sini.
Ihsan gambar:
1. "Model bola dan tongkat molekul air" oleh SoonLorpai - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia
2. "Carbonyl Oxide (Criegee Zwitterion)" oleh Wickey -NL - Kerja Sendiri (CC0) melalui Commons Wikimedia


