Perbezaan antara susunan tindak balas dan molekul
Perbezaan Utama - Urutan Reaksi vs Molekuliti
Reaksi kimia adalah perubahan yang berlaku dalam sebatian kimia. Ia membawa kepada penukaran satu bahan kimia kepada yang lain. Sebatian awal yang menjalani tindak balas kimia dipanggil reaktan. Apa yang kita dapat setelah selesai reaksi adalah produk. Perintah tindak balas diberikan berkenaan dengan bahan; ia boleh berkenaan dengan reaktan, produk atau pemangkin. Perintah tindak balas berkenaan dengan bahan adalah eksponen yang mana kepekatannya dalam persamaan kadar dibangkitkan. Molekul reaksi kimia menyatakan berapa banyak molekul reaktan yang terlibat dalam reaksi. Perbezaan utama antara susunan tindak balas dan molekul ialah Perintah tindak balas memberikan hubungan antara kepekatan spesies kimia dan tindak balas yang menjalani manakala molekul menunjukkan berapa banyak molekul reaktan yang terlibat dalam reaksi.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu urutan reaksi
3. Apakah molekul
4. Perbandingan sampingan - urutan tindak balas vs molekul dalam bentuk jadual
5. Ringkasan
Apa itu urutan reaksi
Perintah tindak balas berkenaan dengan bahan adalah eksponen yang mana kepekatannya dalam persamaan kadar dibangkitkan. Untuk memahami konsep ini, kita harus terlebih dahulu mengetahui undang -undang kadar apa.
Menilai undang -undang
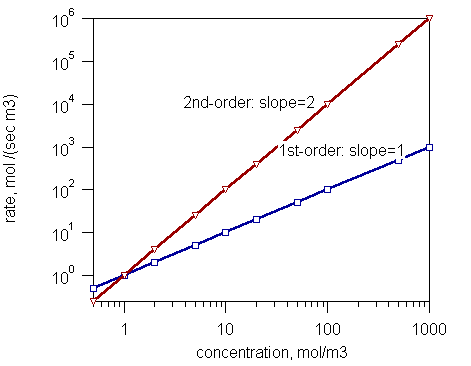
Undang -undang kadar menunjukkan bahawa kadar perkembangan tindak balas kimia (pada suhu malar) adalah berkadar dengan kepekatan reaktan yang dibangkitkan kepada eksponen yang ditentukan secara eksperimen. Eksponen ini dikenali sebagai perintah kepekatan tersebut. Mari kita pertimbangkan contoh.
2n2O5 ↔ 4 no2 + O2
Untuk tindak balas di atas, persamaan undang -undang kadar diberikan seperti di bawah.
Kadar = k.[N2O5]x
Dalam persamaan di atas, k adalah pemalar perkadaran yang dikenali sebagai pemalar kadar. Ia adalah tetap pada suhu malar. Kurungan digunakan untuk menyatakan bahawa ia adalah kepekatan reaktan. Simbol x adalah susunan tindak balas berkenaan dengan reaktan. Nilai x harus ditentukan secara eksperimen. Untuk tindak balas ini, didapati bahawa x = 1. Di sini, kita dapat melihat bahawa urutan tindak balas tidak sama dengan stoikiometri reaksi. Tetapi dalam beberapa tindak balas, urutan tindak balas boleh sama dengan stoikiometri.
Untuk reaksi yang mempunyai dua atau lebih reaktan, Kadar persamaan undang -undang boleh ditulis seperti di bawah.
A+ b+ c ↔ p
Kadar = k.[A]a[B]b[C]c
A, B dan C adalah perintah tindak balas berkenaan dengan reaksi A, B dan C, masing -masing. Untuk persamaan kadar seperti ini (mempunyai beberapa pesanan tindak balas), jumlah pesanan tindak balas diberikan sebagai urutan keseluruhan tindak balas.
Pesanan Keseluruhan = A + B + C

Rajah 1: Kadar urutan pertama dan tindak balas pesanan kedua
Menurut urutan tindak balas, terdapat beberapa jenis reaksi:
- Reaksi pesanan sifar (Perintah tindak balas adalah sifar berkenaan dengan reaktan yang digunakan. Oleh itu kadar tindak balas tidak bergantung kepada kepekatan reaktan yang digunakan.)
- Reaksi pesanan pertama (Kadar berkadar dengan kepekatan satu reaktan)
- Tindak balas pesanan kedua (Kadar tindak balas adalah berkadar sama ada ke kuadrat kepekatan reaktan atau produk kepekatan dua reaktan)
Apakah molekul
Molekul reaksi adalah bilangan molekul atau ion yang mengambil bahagian dalam tindak balas sebagai reaktan. Lebih penting lagi, reaktan yang dipertimbangkan adalah yang mengambil bahagian dalam langkah penentuan kadar reaksi keseluruhan. Kadar menentukan langkah tindak balas adalah langkah paling lambat dari reaksi keseluruhan. Ini kerana langkah tindak balas yang paling lambat menentukan kadar tindak balas.
Rajah 2: Reaksi yang tidak penting
Molekul boleh menjadi pelbagai jenis:
- Reaksi Unimolecular mempunyai satu molekul reaktan (atau ion)
- Reaksi bimolecular mempunyai dua reaktan (dua reaktan boleh dari sebatian yang sama atau sebatian yang berbeza)
- Reaksi Trimolecular mempunyai tiga reaktan.
Apakah perbezaan antara susunan tindak balas dan molekul?
Susunan tindak balas vs molekul | |
| Perintah tindak balas berkenaan dengan bahan adalah eksponen yang mana kepekatannya dalam persamaan kadar dibangkitkan. | Molekul reaksi adalah bilangan molekul atau ion yang mengambil bahagian dalam tindak balas sebagai reaktan. |
| Hubungan dengan reaktan | |
| Perintah tindak balas menerangkan bagaimana kepekatan reaktan mempengaruhi kadar tindak balas. | Molekul memberikan bilangan reaktan yang mengambil bahagian dalam reaksi. |
Ringkasan - Perintah Reaksi vs Molekuliti
Undang -undang kadar menunjukkan bahawa kadar perkembangan tindak balas kimia (pada suhu malar) adalah berkadar dengan kepekatan reaktan yang dibangkitkan kepada eksponen yang ditentukan secara eksperimen. Perintah tindak balas diberikan berkenaan dengan reaktan. Ia menerangkan pergantungan kadar tindak balas terhadap kepekatan reaktan. Perbezaan utama antara susunan tindak balas dan molekul adalah bahawa urutan tindak balas memberikan hubungan antara kepekatan spesies kimia dan tindak balas yang menjalani sedangkan molekul mengekspresikan berapa banyak molekul reaktan yang terlibat dalam reaksi.
Rujukan:
1. "Undang -undang kadar."Kimia Libretexts, Libretexts, 21 Julai 2016, boleh didapati di sini.
2. "Perintah tindak balas."Kimia Libretexts, Libretexts, 21 Julai 2016, boleh didapati di sini.
3. "Molekul dan kinetik."Kimia Libretexts, Libretexts, 21 Julai 2016, boleh didapati di sini.
Ihsan gambar:
1. "Rateloglogplot" oleh Fabiuccio ~ Enwikibooks di Wikibooks Bahasa Inggeris - dipindahkan dari en.Wikibooks ke Commons., (Domain Awam) melalui Wikimedia Commons
2. "CIS-Trans-Stilbene" oleh Pancrat-Kerja Sendiri (CC BY-SA 3.0) melalui Commons Wikimedia


