Perbezaan antara isotonik dan isosmotik
The Perbezaan utama antara isotonik dan isosmotik adalah bahawa Penyelesaian isotonik hanya mengandungi larutan yang tidak menembusi manakala penyelesaian isosmotik mengandungi kedua-dua penembusan dan juga larutan penembusan. Satu lagi perbezaan penting antara penyelesaian isotonik dan isosmotik adalah bahawa penyelesaian isotonik mempunyai tekanan osmotik yang berbeza dari sel -sel yang mereka mengelilingi manakala penyelesaian isosmotik mempunyai tekanan osmotik yang sama seperti sel -sel yang mereka mengelilingi.
Isotonik dan isosmotik adalah jenis penyelesaian dan istilah yang sering kita hadapi dalam makmal kimia. Ramai yang tetap keliru tentang perbezaan antara kedua -dua jenis penyelesaian yang mempercayai bahawa mereka adalah sama. Walau bagaimanapun, mereka tidak sama dan kami akan menyerlahkan perbezaan mereka dalam artikel ini.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu larutan
3. Apa itu Isotonik
4. Apa itu isosmotik
5. Perbandingan sampingan - isotonik vs isosmotik dalam bentuk jadual
6. Ringkasan
Apa itu larutan?
Larutan adalah bahan yang dibubarkan dalam penyelesaian. Untuk memahami penyelesaian isosmotik dan isotonik, kita harus menyedari bahawa mereka sama ada menembusi larutan atau larutan yang tidak menembusi. Larutan menembusi adalah yang boleh melalui membran sel yang mempengaruhi tekanan osmotik merentasi membran. Sebaliknya, larutan tidak menembusi tidak dapat melalui membran yang sebabnya mereka hanya mempengaruhi tonik.
Apa itu Isotonik?
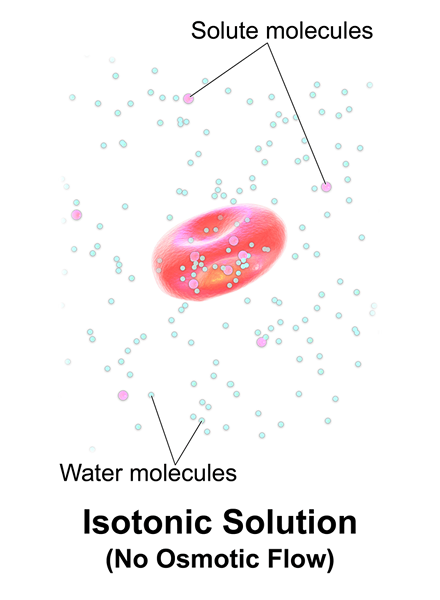
Isotonik adalah ketika penyelesaian mempunyai kepekatan garam yang sama seperti darah dan sel tubuh manusia. Penyelesaian isotonik hanya mengandungi larutan yang tidak menembusi dan merujuk kepada penyelesaian yang mempunyai tekanan osmotik yang sama seperti sel yang mereka kelilingi.

Rajah 01: Penyelesaian isotonik
Selain itu, mereka tidak menyerap apa -apa dari sel dan sebaliknya (sel juga tidak menyerap larut dari penyelesaian ini). Sebagai contoh, penyelesaiannya adalah 154 MMNACL adalah isotonik untuk manusia.
Apa itu isosmotik?
Isosmotik adalah ketika dua penyelesaian mempunyai jumlah larutan yang sama. Oleh itu, walaupun mereka mempunyai tekanan osmotik yang sama seperti sel, mereka mengelilingi. Mereka mengandungi larutan menembusi yang boleh memasuki dan meningkatkan tekanan osmotik sel. Apabila tekanan osmotik sel meningkat menyebabkan sel menyerap air dari medium, ia mencapai keseimbangan dan tekanan osmotik sama dengan kedua -dua belah pihak. Ini mungkin memberi kesan ke atas sel sehingga akhirnya dapat pecah.
Sebagai contoh, sukrosa adalah penyelesaian yang tidak mempunyai ion. Penyelesaian sukrosa iaitu 320 mm adalah isosmotik untuk manusia. Membandingkan penyelesaian sukrosa ini dengan larutan NaCl 154mm, ia mendedahkan bahawa ia adalah 154 mmsodium (NA) dan 154 mmchloride (CL) atau kira -kira 308 milliosmolar yang hampir 320 milliosmolar untuk sukrosa.
Apakah perbezaan antara isotonik dan isosmotik?
Isotonik merujuk kepada penyelesaian yang mempunyai kepekatan larut yang sama seperti dalam sel atau cecair badan. Isosmotik merujuk kepada keadaan dua penyelesaian yang mempunyai tekanan osmotik yang sama. Oleh itu, penyelesaian isotonik hanya mengandungi larutan yang tidak menembusi manakala penyelesaian isosmotik mengandungi kedua-dua penembusan dan juga penembusan larutan.
Dengan pertimbangan terhadap hubungan kedua -dua jenis penyelesaian ini dengan tekanan osmotik, penyelesaian isotonik mempunyai tekanan osmotik yang berbeza dari sel -sel yang mereka kelilingi. Sebaliknya, penyelesaian isosmotik mempunyai tekanan osmotik yang sama seperti sel -sel yang mereka sekeliling. Tambahan pula, penyelesaian isotonik tidak menyebabkan sel menyerap air dari sekitar atau kehilangan air dari sel. Walau bagaimanapun, penyelesaian isosmotik menyebabkan sel menyerap air dari sekitar atau kehilangan air dari sel.
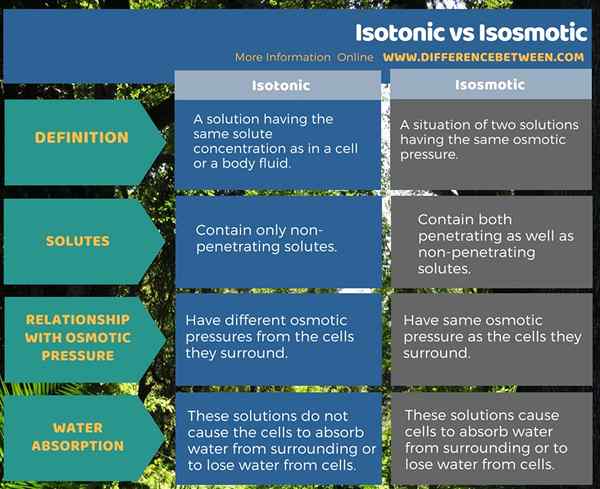
Ringkasan -isotonik vs isosmotik
Istilah isotonik dan isosmotik berguna dalam menerangkan sifat -sifat cecair badan. Kedua -dua istilah, isotonik menyatakan idea mempunyai kepekatan larut yang sama manakala istilah isosmotik menyatakan idea mempunyai tekanan osmotik yang sama. Perbezaan antara isotonik dan isosmotik adalah bahawa penyelesaian isotonik hanya mengandungi larutan tidak menembusi sedangkan penyelesaian isosmotik mengandungi kedua-dua penembusan serta larutan tidak menembusi.
Rujukan:
1. "Tonicity."Wikipedia, Yayasan Wikimedia, 8 Feb. 2018. Terdapat di sini
2. "Isosmotik."Biologi dalam talian. Terdapat di sini
Ihsan gambar:
1.'Blausen 0685 osmoticflow isotonic'by blausen.Kakitangan Com (2014). "Galeri Perubatan Blausen Medical 2014". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.010. ISSN 2002-4436. - Kerja sendiri, (CC oleh 3.0) melalui Commons Wikimedia


