Perbezaan antara ester dan eter

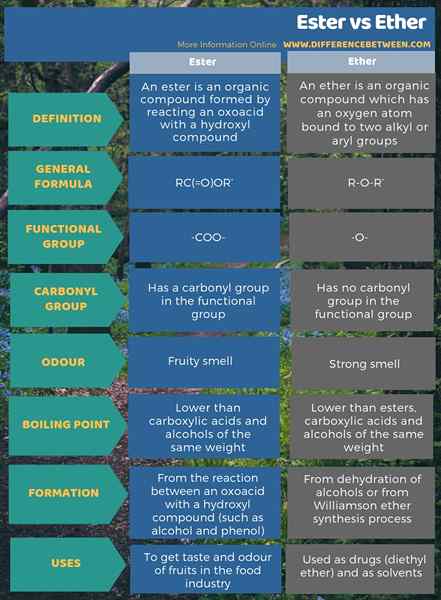
Perbezaan utama antara ester dan eter ialah kumpulan fungsional ester adalah -Coo, sedangkan kumpulan fungsional eter adalah -o-.
Ester dan eter adalah molekul organik dengan atom oksigen. Ester mempunyai kumpulan -coo. Di sini, satu atom oksigen terikat kepada karbon dengan ikatan berganda, dan oksigen lain terikat dengan satu ikatan. Oleh kerana hanya tiga atom bersambung dengan atom karbon, ia mempunyai geometri planar trigonal di sekelilingnya. Tambahan pula, atom karbon adalah SP2 hibridisasi. Selain itu, ester adalah derivatif asid karboksilik. Sebaliknya, eter mempunyai atom oksigen dengan dua ikatan tunggal dengan dua kumpulan alkil atau aril. Atom oksigen mempunyai dua pasangan elektron tunggal.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Ester
3. Apa itu eter
4. Perbandingan sampingan - ester vs eter dalam bentuk jadual
5. Ringkasan
Apa itu Ester?
Ester adalah sebatian organik yang terbentuk dengan reaksi oxoacid dengan sebatian hidroksil (seperti alkohol dan fenol). Ia menyerupai asid karboksilik yang mempunyai atom hidrogen kumpulan -COOH digantikan oleh kumpulan alkil atau aril. Ester adalah molekul kutub, tetapi titik mendidih mereka lebih rendah daripada asid karboksilik yang sama dengan berat badan yang sama. Kerana ester tidak dapat membentuk ikatan hidrogen di antara mereka. Walau bagaimanapun, mereka boleh membentuk ikatan hidrogen antara atom oksigen dan atom hidrogen molekul air. Oleh itu, ester sedikit larut dalam air.

Rajah 01: Struktur umum ester
Tambahan pula, ester mempunyai bau buah, yang berbeza dengan asid karboksilik yang sepadan (asid biasanya mempunyai bau yang tidak menyenangkan). Malah, ester ini adalah sebab bau banyak buah -buahan; Sebagai contoh, nanas mendapat bau dari etil etanoat. Dan, fenomena ini telah membawa kepada penggunaan ester dalam industri makanan.
Walau bagaimanapun, ester yang kita gunakan dalam produk tertentu untuk mendapatkan bau buah yang dikehendaki bukanlah sebatian yang sama yang terdapat di sumber semula jadi. Walau bagaimanapun, ester dapat menghasilkan rasa dan bau yang sama. Lebih -lebih lagi, walaupun sebatiannya tidak sama seperti dalam buah semulajadi, tidak berbahaya untuk memakan produk makanan ini kerana struktur ester hampir sama dengan kompaun semulajadi.
Apa itu eter
Ether adalah sebatian organik yang mempunyai atom oksigen yang terikat kepada dua kumpulan alkil atau aril. Kita boleh menamakan eter mudah sebagai ether alkil kerana ia mengandungi dua kumpulan alkil kecil yang dilampirkan pada atom oksigen. Dalam tatanannya, kita perlu menyenaraikan kumpulan alkil dalam susunan abjad dan menambah istilah "eter" pada akhir. Sebagai contoh, jika eter mempunyai kumpulan metil dan kumpulan n-butil yang terikat kepada atom oksigen, kita namakannya sebagai "n-butilmetil eter".
Ethers boleh membubarkan pelbagai sebatian kutub dan nonpolar. Ini terutamanya kerana ether tidak mempunyai rangkaian ikatan hidrogen yang perlu dipecahkan untuk membubarkan larutan. Oleh itu, sebatian nonpolar cenderung membubarkan dietil eter lebih baik daripada alkohol.
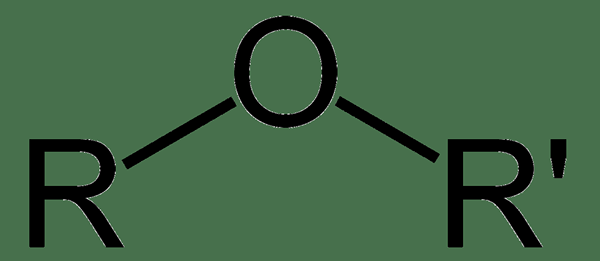
Rajah 02: Struktur umum eter
Dalam struktur umum eter, oksigen mempunyai SP3 hibridisasi, dan dua pasangan tunggal berada dalam dua orbital hibrida manakala dua mengambil bahagian dalam ikatan dengan kumpulan r. Sudut Bond R-O-R 'adalah kira-kira 104.5 °, yang serupa dengan air. Titik mendidih eters hampir setanding dengan hidrokarbon dengan berat molekul yang sama, tetapi titik mendidih eters kurang daripada nilai alkohol. Walaupun Ethers tidak dapat membuat ikatan hidrogen di dalamnya, mereka dapat membentuk ikatan hidrogen dengan sebatian lain seperti air. Oleh itu, eters larut dalam air, tetapi kelarutan boleh berkurangan bergantung pada panjang rantai hidrokarbon yang dilampirkan.
Apakah perbezaan antara ester dan eter?
Ester adalah sebatian organik yang dibentuk oleh tindak balas oxoacid dengan sebatian hidroksil. Sebaliknya, eter adalah sebatian organik yang mempunyai atom oksigen yang terikat kepada dua kumpulan alkil atau aril. Perbezaan utama antara ester dan eter ialah kumpulan fungsional ester adalah -coo, sedangkan kumpulan fungsional eter adalah -o-. Formula kimia umum ester dan eter masing-masing adalah rc (= o) atau 'dan r-o-r'. Selain itu, satu lagi perbezaan yang signifikan antara ester dan eter adalah bahawa ester mempunyai kumpulan karbonil dalam kumpulan fungsinya di mana eter tidak.
Lebih penting lagi, ester mempunyai bau buah, sementara eter mempunyai bau ethereal yang kuat. Oleh itu, kita boleh menganggap ini juga sebagai perbezaan antara ester dan eter. Juga, ester mempunyai titik mendidih yang lebih rendah daripada asid karboksilik dan alkohol dengan berat yang sama manakala eter mempunyai titik mendidih lebih rendah daripada ester, asid karboksilik, dan alkohol dengan berat yang sama.
Ringkasan -Ester vs Ether
Ester adalah sebatian organik yang membentuk dengan bertindak balas dengan oxoacid dengan sebatian hidroksil. Sebaliknya, eter adalah sebatian organik yang mempunyai atom oksigen yang terikat kepada dua kumpulan alkil atau aril. Perbezaan utama antara ester dan eter ialah kumpulan fungsional ester adalah -coo, sedangkan kumpulan fungsional eter adalah -o-.
Rujukan:
1. Derosa, Thomas F. Kemajuan dalam Kimia Organik Sintetik dan Kaedah yang Dilaporkan dalam Paten AS. Elsevier, 2006.
2. Ouellette, Robert J., dan j. David Rawn. Kimia Organik: Struktur, Mekanisme, dan Sintesis. Elsevier, 2014.
Ihsan gambar:
1. "Ester-General" oleh Sakurambo ~ Commonswiki diasumsikan. Kerja sendiri diandaikan (berdasarkan tuntutan hak cipta)., Domain awam) melalui Wikimedia Commons
2. "Ether- (Umum)" oleh Benjah-Bmm27 diasumsikan. Kerja sendiri diandaikan (berdasarkan tuntutan hak cipta) (domain awam) melalui Wikimedia Commons


