Perbezaan antara titik akhir dan titik stoikiometrik
The Perbezaan utama antara titik akhir dan titik stoikiometri ialah titik akhir datang hanya selepas titik stoikiometrik, sedangkan titik stoikiometrik adalah titik yang paling tepat di mana peneutralan selesai.
Titrasi asas asid melibatkan tindak balas peneutralan, yang berlaku pada titik di mana asid bertindak balas dengan jumlah asas yang sama dengan kimia. Walau bagaimanapun, terdapat sedikit perbezaan antara titik teoretikal di mana tindak balasnya berakhir dan titik di mana kita mengesannya secara praktikal. Selain itu, anda juga perlu ambil perhatian bahawa titik kesetaraan istilah adalah nama yang lebih biasa digunakan untuk titik stoikiometrik.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu titik akhir
3. Apa itu titik stoikiometri
4. Perbandingan sampingan - titik akhir vs titik stoikiometrik dalam bentuk jadual
5. Ringkasan
Apa itu titik akhir?
Titik di mana tindak balas seolah -olah selesai adalah titik akhir titrasi. Kita boleh secara eksperimen menentukan perkara ini. Marilah kita mempertimbangkan contoh untuk memahami perkara ini secara praktikal. Anggap kita titrate 100 ml 0.1 m asid hidroklorik (HCl) dengan 0.5 m sodium hidroksida.
HCl(aq) + NaOH(aq) ⟶ h2O + NaCl(aq)
Kami menyimpan asid dalam kelalang titrasi dan titrating terhadap NaOH dengan kehadiran metil oren sebagai penunjuk. Dalam medium berasid, penunjuk tidak berwarna dan ia menunjukkan warna merah jambu dalam medium asas. Pada mulanya, hanya ada asid (HCl 0.1 m/100 ml) dalam botol titrasi; pH penyelesaiannya sama dengan 2. Apabila kita menambah NaOH, pH penyelesaian meningkat disebabkan oleh peneutralan beberapa jumlah asid dalam medium. Kita perlu menambah asas secara berterusan jatuh dengan kejatuhan sehingga mencapai siap. PH tindak balas menjadi sama dengan 7 apabila tindak balas selesai. Walaupun pada ketika ini, penunjuk tidak menunjukkan warna dalam medium kerana ia mengubah warna dalam medium asas.
Untuk memerhatikan perubahan warna, kita perlu menambah satu setitik lagi NaOH, walaupun selepas selesai penetapan. PH penyelesaian secara drastik berubah pada ketika ini. Ini adalah titik di mana kita memerhatikan sebagai tindak balas selesai.
Apa itu titik stoikiometri?
Titik kesetaraan adalah nama umum untuk titik stoikiometrik. Ia adalah titik di mana asid atau asas menyelesaikan reaksi peneutralannya. Reaksi selesai secara teoritis pada ketika ini, tetapi secara praktikal kita tidak dapat melihat titik yang tepat. Lebih baik jika kita dapat menentukan apabila titik setara dicapai kerana ia adalah titik yang tepat di mana peneutralan telah berlaku. Walau bagaimanapun, kita dapat melihat penyelesaian tindak balas di titik akhir.

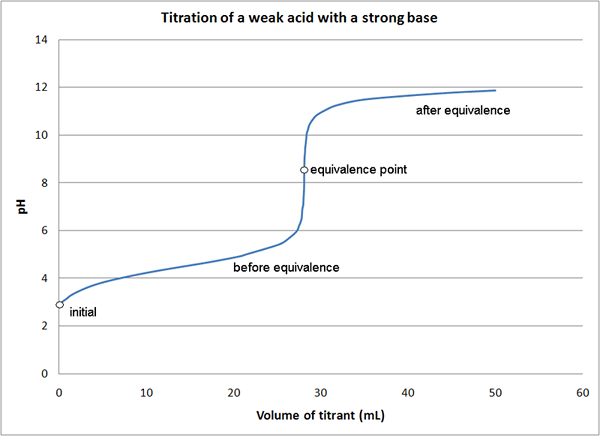
Rajah 01: Graf untuk titrasi menunjukkan titik kesetaraan
Jika kita menganggap contoh yang sama seperti di atas, pada permulaan tindak balas, kita hanya mempunyai asid dalam medium (HCl). Sebelum mencapai titik kesetaraan, dengan penambahan NaOH, kami mempunyai asid yang tidak bereaksi dan membentuk garam (HCl dan NaCl). Pada titik kesetaraan, kita hanya mempunyai garam dalam medium. Di titik akhir, kita mempunyai garam dan pangkalan (NaCl dan NaOH) dalam medium.
Apakah perbezaan antara titik akhir dan titik stoikiometri?
Titik akhir dan titik stoikiometri (yang sama, titik kesetaraan) selalu berbeza antara satu sama lain. Perbezaan utama antara titik akhir dan titik stoikiometri ialah titik akhir datang hanya selepas titik stoikiometrik, sedangkan titik stoikiometrik adalah titik yang paling tepat di mana peneutralan selesai. Tambahan pula, kita dapat melihat titik akhir tetapi tidak dapat melihat titik stoikiometri praktikal.

Ringkasan -titik akhir vs titik stoikiometri
Titik akhir dan titik stoikiometri (yang sama, titik kesetaraan) selalu berbeza antara satu sama lain. Perbezaan utama antara titik akhir dan titik stoikiometri ialah titik akhir datang hanya selepas titik stoikiometrik, sedangkan titik stoikiometrik adalah titik yang paling tepat di mana peneutralan selesai.
Rujukan:
1. Helmenstine, Anne Marie. "Definisi titik kesetaraan."Thoughtco, Mei. 7, 2019, boleh didapati di sini.
Ihsan gambar:
1."Titrasi asid lemah dengan asas yang kuat" oleh QuantumKinetics - Kerja Sendiri (CC oleh 3.0) melalui Commons Wikimedia


