Perbezaan antara langkah asas dan kadar menentukan langkah
The Perbezaan utama antara langkah asas dan langkah penentuan kadar adalah bahawa Langkah -langkah asas adalah tindak balas kimia di mana reaktan bertindak balas untuk memberikan produk akhir atau pertengahan manakala langkah penentuan kadar adalah langkah reaksi yang paling lambat dari proses multistep.
Istilah langkah asas dan langkah penentuan kadar digunakan dalam membincangkan kadar tindak balas tindak balas kimia, terutamanya apabila terdapat dua atau lebih langkah sebelum membentuk produk akhir. Setiap langkah proses multistep ini dipanggil langkah asas. Langkah -langkah ini mempunyai kadar yang berbeza. Langkah menentukan kadar proses mempunyai kadar paling lambat.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah langkah asas
3. Berapakah langkah menentukan kadar
4. Perbandingan sampingan - langkah asas vs kadar menentukan langkah dalam bentuk jadual
5. Ringkasan
Apakah langkah asas?
Langkah -langkah asas adalah langkah tunggal yang termasuk dalam proses multistep. Langkah asas adalah tindak balas kimia di mana satu atau dua reaktan bertindak balas untuk memberikan produk akhir atau produk pertengahan. Ini adalah langkah tindak balas tunggal, dan ia mempunyai satu keadaan peralihan. Umumnya, jika tidak ada produk perantaraan yang dihasilkan semasa tindak balas kimia tertentu, tindak balas ini dipanggil reaksi asas. Selain itu, mekanisme tindak balas kimia adalah koleksi langkah -langkah asas. Oleh itu, tindak balas asas menggambarkan satu saat semasa tindak balas di mana molekul memecahkan dan/atau membentuk ikatan baru.
Jumlah semua langkah asas yang seimbang memberikan reaksi keseluruhan. Langkah -langkah asas proses multistep mempunyai kadar tindak balas yang berbeza; e.g. beberapa langkah asas berlaku dengan pantas sementara langkah -langkah lain sangat perlahan. Oleh itu, langkah penentuan kadar atau langkah paling lambat tindak balas juga merupakan jenis tindak balas asas.
Reaksi asas dapat dikategorikan berdasarkan molekul mereka. Di sini, bilangan molekul yang terlibat dalam tindak balas digunakan untuk memberikan molekul langkah asas. E.g. Sekiranya terdapat satu reaktan, ia tidak begitu penting, dan jika terdapat dua reaktan, ia adalah bimolecular. Unimolecular dan bimolecular adalah jenis reaksi asas yang paling biasa. Reaksi termolecular (tiga reaktan) jarang berlaku kerana perlanggaran tiga molekul pada masa yang sama jarang berlaku.
Berapakah langkah menentukan kadar?
Langkah penentuan kadar adalah langkah paling lambat dari proses reaksi multistep. Ini adalah satu langkah di antara satu siri langkah. Walau bagaimanapun, beberapa tindak balas hanya mempunyai satu tindak balas kimia (bukan satu siri reaksi); Oleh itu, tindak balas ini selalu menjadi tindak balas penentuan kadar. Tindak balas yang mempunyai kadar paling lambat diambil sebagai kadar penentuan kadar kerana ia mengehadkan kadar tindak balas.

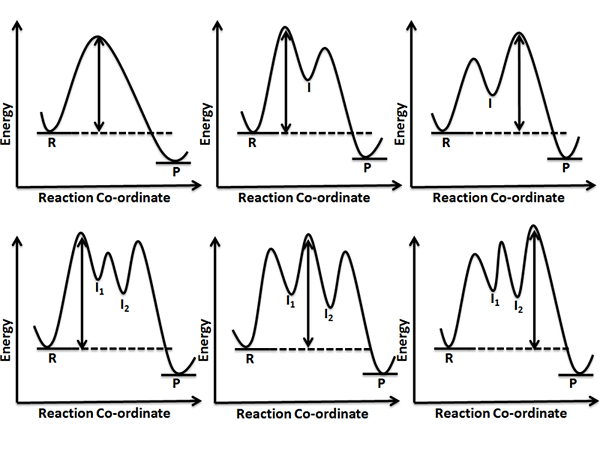
Rajah 01: Anak panah berkepala dua menunjukkan kadar menentukan langkah setiap tindak balas
Contoh diberikan di bawah.
NO2 +NO2 → NO +NO3 (langkah perlahan, penentuan kadar)
NO3+ CO → NO2+ CO2 (langkah pantas)
Apakah perbezaan antara langkah asas dan kadar menentukan langkah?
Perbezaan utama antara langkah asas dan langkah penentuan kadar ialah langkah -langkah asas adalah tindak balas kimia di mana reaktan bertindak balas untuk memberikan produk akhir atau pertengahan sedangkan langkah menentukan kadar adalah langkah reaksi yang paling lambat dari proses multistep. Oleh itu, langkah asas boleh menjadi cepat atau lambat, sementara langkah menentukan kadar selalu langkah paling lambat.
Di bawah infographic meringkaskan perbezaan antara langkah asas dan kadar menentukan langkah.
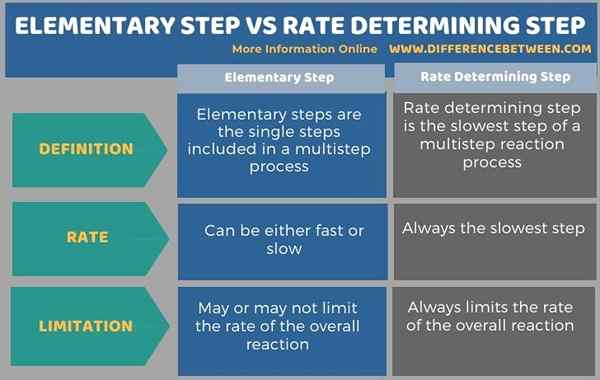
Ringkasan -langkah asas vs kadar menentukan langkah
Istilah langkah asas dan langkah penentuan kadar digunakan dalam membincangkan kadar tindak balas tindak balas kimia apabila terdapat dua atau lebih langkah yang berlaku sebelum membentuk produk akhir. Perbezaan utama antara langkah asas dan langkah penentuan kadar ialah langkah -langkah asas adalah tindak balas kimia di mana reaktan bertindak balas untuk memberikan produk akhir atau pertengahan sedangkan langkah menentukan kadar adalah langkah reaksi yang paling lambat dari proses multistep.
Rujukan:
1. "Langkah Elementary."Kimia Libretexts, Libretexts, 19 Mei 2020, boleh didapati di sini.
2. "Kimia Boundless."Lumen, boleh didapati di sini.
3. "Reaksi Asas."Wikipedia, Yayasan Wikimedia, 5 Sept. 2019, boleh didapati di sini.
Ihsan gambar:
1. "Rajah koordinat reaksi untuk reaksi dengan 0, 1, 2 perantaraan" oleh AIMNature-Kerja Sendiri (CC BY-SA 3.0) melalui Commons Wikimedia


