Perbezaan antara elektropositif dan elektronegatif
The Perbezaan utama antara elektropositif dan elektronegatif ialah Electropositive merujuk kepada keupayaan untuk kehilangan elektron, membentuk kation, sedangkan elektronegatif merujuk kepada keupayaan untuk mendapatkan elektron, membentuk anion.
Istilah elektropositif dan elektronegatif datang dengan tarikan atau penolakan unsur kimia ke arah elektron. Kita boleh mengkategorikan elemen kimia mengikut ciri ini; Sama ada mereka kehilangan atau mendapatkan elektron semasa tindak balas kimia.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Electropositive
3. Apakah elektronegatif
4. Perbandingan sampingan - Electropositive vs elektronegatif dalam bentuk jadual
5. Ringkasan
Apa itu Electropositive?
Electropositive bermaksud elemen kimia cenderung kehilangan elektron. Kehilangan elektron membentuk kation atau ion yang dicas positif dalam tindak balas kimia. Ini adalah ukuran keupayaan elemen untuk menderma elektron. Unsur -unsur cenderung kehilangan elektron mereka untuk mendapatkan konfigurasi elektron gas mulia.
Biasanya, semua logam dianggap sebagai elemen kimia elektropositif kerana mereka mempunyai elektron yang mudah ditanggalkan di orbital paling luar mereka. Antaranya, Logam Alkali (Kumpulan 1 Elemen Kimia) adalah elemen yang paling elektropositif. Secara teorinya, Francium adalah elemen kimia yang paling elektropositif, walaupun tidak stabil. Walaupun hidrogen berada dalam kumpulan1 jadual berkala, ia boleh kehilangan atau mendapatkan elektron; Oleh itu, kita boleh mengkategorikannya di bawah kedua -dua elemen elektropositif dan elektronegatif.
Apakah elektronegatif?
Elektronegatif merujuk kepada keupayaan elemen kimia untuk mendapatkan elektron. Memperoleh elektron dari anion bentuk luar; Anion adalah spesies kimia yang dikenakan secara negatif. Elektronegativiti adalah kebalikan dari elektropositiviti. Simbol untuk fenomena ini adalah χ. Istilah ini boleh merujuk kepada tarikan sama ada pasangan elektron bersama atau ketumpatan elektron ke arah dirinya sendiri. Terdapat dua faktor utama yang mempengaruhi elektronegativiti elemen kimia: bilangan atom dan jarak antara nukleus dan elektron valensi.

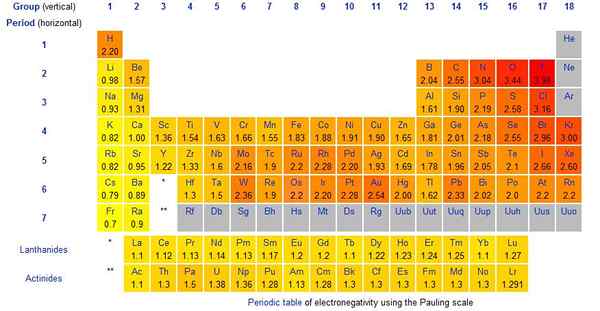
Rajah 01: Nilai skala Pauling untuk elemen kimia
Skala Pauling adalah kaedah yang kami gunakan untuk memberi nilai kepada elektronegativiti elemen kimia. Skala itu dicadangkan oleh Linus Pauling. Ia adalah kuantiti tanpa dimensi. Selain itu, ia adalah skala relatif yang menganggap elektronegativiti berkisar dari 0.79 hingga 3.98. Elektronegativiti hidrogen adalah 2.20. Unsur yang paling elektronegatif adalah fluorin, dan nilai skala Pauling adalah 3.98 (biasanya kita mengambilnya sebagai 4). Biasanya, semua halogen (kumpulan 7 elemen) sangat elektronegatif.
Apakah perbezaan antara elektropositif dan elektronegatif?
Perbezaan utama antara elektropositif dan elektronegatif ialah istilah elektropositif merujuk kepada keupayaan untuk kehilangan elektron, membentuk kation, sedangkan elektronegatif merujuk kepada keupayaan untuk mendapatkan elektron, membentuk anion. Tambahan pula, apabila mempertimbangkan unsur -unsur kimia di bahagian atas senarai, dalam senarai elemen elektropositif, elemen yang paling elektropositif adalah francium manakala di antara unsur -unsur elektronegatif, unsur paling elektronegatif adalah fluorin.
Skala Pauling adalah skala yang kita gunakan untuk memberi nilai kepada setiap elemen elektropositif dan elektronegatif. Walau bagaimanapun, skala ini memberikan elektronegativiti elemen; Oleh itu, kita dapat menentukan bahawa nilai elektronegativiti yang sangat rendah menunjukkan bahawa elemen lebih banyak elektropositif.
Di bawah infographic meringkaskan perbezaan antara elektropositif dan elektronegatif.

Ringkasan -Electropositive vs Electronegative
Istilah elektropositif dan elektronegatif menggambarkan tarikan atau penolakan unsur kimia ke arah elektron. Perbezaan utama antara elektropositif dan elektronegatif ialah istilah elektropositif merujuk kepada keupayaan untuk kehilangan elektron yang membentuk kation, sedangkan elektronegatif merujuk kepada keupayaan untuk mendapatkan elektron yang membentuk anion.
Skala Pauling adalah skala yang kita gunakan untuk memberi nilai kepada setiap elemen elektropositif dan elektronegatif. Skala ini memberikan elektronegativiti unsur; Oleh itu, kita dapat menentukan bahawa nilai elektronegativiti yang sangat rendah menunjukkan bahawa elemen lebih banyak elektropositif.
Rujukan:
1."Electronegativity."Wikipedia, Yayasan Wikimedia, 13 Sept. 2019, boleh didapati di sini.
2. "Mengapa logam yang dipanggil Electropositive Elements YNOSB3SS -CHEMISTRY."Topperlearning, boleh didapati di sini.
Ihsan gambar:
1. "Elektronegatif" oleh Adblocker - Kerja Sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia


