Perbezaan antara cuprous dan cuprik
Perbezaan utama -Cuprous vs Cupric
Kation yang stabil yang dibentuk oleh tembaga, yang merupakan elemen blok d, adalah kation dan kation cuprik. Ion cuprous dan cuprik berbeza antara satu sama lain berdasarkan konfigurasi elektronik mereka. The Perbezaan utama antara cuprous dan cuprik adalah bahawa cuprous adalah tembaga 1+ kation manakala cupric adalah tembaga +2 kation.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu cuprous
3. Apa itu Cupric
4. Persamaan antara cuprous dan cuprik
5. Perbandingan sampingan - cuprous vs cupric dalam bentuk jadual
6. Ringkasan
Apa itu cuprous?
Nama cuprous diberikan kepada kation +1 yang dibentuk oleh atom tembaga. Ia dilambangkan oleh CU+1. Konfigurasi elektron atom tembaga adalah [AR] 3D10 4s1. Apabila kation yang terbentuk, konfigurasi elektron adalah [AR] 3D10 4s0. Oleh itu, kation cuprous dibentuk apabila satu elektron dikeluarkan dari atom tembaga. Oleh kerana kation cuprous dapat mengikat dengan hanya satu anion lain dengan keadaan pengoksidaan -1, kation cuprous dikenali sebagai a kation monovalen. Konfigurasi elektron kation cuprous sangat stabil. Oleh itu, terdapat banyak sebatian yang dibentuk oleh kation ini. Beberapa contoh ditunjukkan di bawah:
- Cuprous oksida (CU2O)
- Cuprous Iodide (CUI)
- Sulfida cuprous (CU2S)
Tenaga penghidratan molekul atau ion adalah jumlah tenaga yang dikeluarkan apabila satu mole penghidratan u8ndergo sebatian itu (pembubaran dalam air).

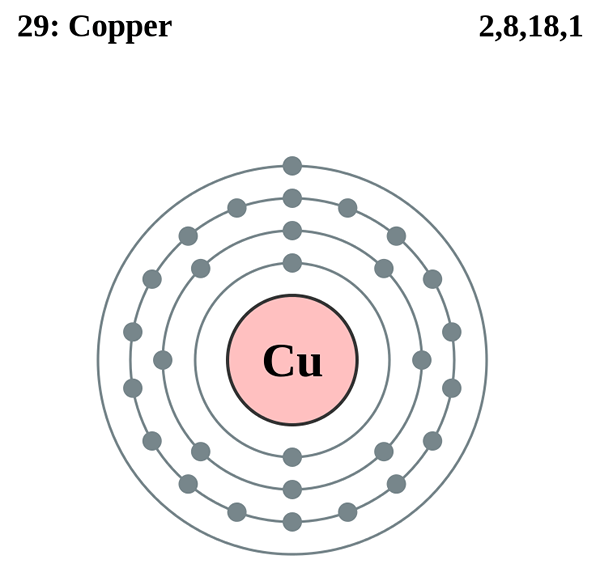
Rajah 01: Struktur atom tembaga
Ion cuprous mempunyai tenaga penghidratan yang rendah berbanding dengan ion cuprik kerana d10 Konfigurasi elektron dalam ion cuprous stabil daripada d9 Konfigurasi elektron dalam ion cuprik.
Apa itu Cupric?
Nama cupric diberikan kepada kation +2 yang dibentuk oleh atom tembaga. Ia dilambangkan oleh CU2+. Konfigurasi elektron atom tembaga adalah [AR] 3D10 4s1. Apabila kation cuprik dibentuk, konfigurasi elektron adalah [AR] 3D9 4s0. Kation cuprik dibentuk apabila dua elektron dikeluarkan dari atom tembaga, memberikan atom A 2+ cas elektrik. Kation cuprik boleh mengikat sama ada dua anion mempunyai keadaan pengoksidaan -1 atau satu anion yang mempunyai keadaan pengoksidaan -2. Oleh itu, kation cuprik adalah kation divalen. Sebatian yang dibentuk dengan kation ini termasuk berikut:
- Cupric Oxide (CUO)
- Cupric Iodide (CUI)
- Sulfida cuprik (cus)
Apakah persamaan antara cuprous dan cuprik?
- Kedua -dua cuprous dan cuprik adalah kation yang terbentuk daripada kehilangan elektron dari atom tembaga.
- Kedua -duanya adalah kation yang stabil.
- Kedua -duanya mempunyai caj elektrik yang positif.
- Kedua -duanya mempunyai jisim atom yang sama (kerana jisim elektron boleh diabaikan).
Apakah perbezaan antara cuprous dan cuprik?
Cuprous vs cupric | |
| Nama cuprous diberikan kepada kation +1 yang dibentuk oleh atom tembaga. | Nama cupric diberikan kepada kation +2 yang dibentuk oleh atom tembaga. |
| Kategori | |
| Ion cuprous adalah kation monovalen. | Ion cuprik adalah kation divalen. |
| Konfigurasi elektron | |
| Konfigurasi elektron ion cuprous ialah [AR] 3D10 4s0. | Konfigurasi elektron ion cuprik ialah [AR] 3D9 4s0. |
| Elektron kalah untuk membentuk atom tembaga | |
| Ion cuprous dibentuk apabila satu elektron hilang dari atom tembaga. | Ion cuprik dibentuk apabila dua elektron hilang dari atom tembaga. |
| Kestabilan | |
| Kestabilan ion cuprous adalah tinggi kerana d10 konfigurasi elektron. | Kestabilan ion cuprik adalah rendah kerana d9 konfigurasi elektron. |
| Denotasi | |
| Ion cuprous dilambangkan oleh CU+1. | Ion cuprik dilambangkan oleh CU2+. |
| Caj elektrik | |
| Ion cuprous mempunyai +1 cas elektrik. | Ion cuprik mempunyai +2 cas elektrik. |
| Tenaga penghidratan | |
| Tenaga penghidratan ion cuprous adalah rendah berbanding dengan ion cuprik. | Tenaga penghidratan ion cuprik adalah tinggi jika dibandingkan dengan ion cuprous. |
Ringkasan -Cuprous vs Cupric
Ion cuprous dan ion cuprik adalah kation yang terbentuk daripada atom tembaga kerana kehilangan elektron. Perbezaan antara cuprous dan cuprik adalah bahawa cuprous adalah tembaga 1+ kation sedangkan cupric adalah tembaga +2 kation.
Rujukan:
1. "Tembaga."Wikipedia, Yayasan Wikimedia, 3 Apr. 2018. Terdapat di sini
2. "Kation Cupric."Pusat Kebangsaan Maklumat Bioteknologi. Pangkalan data kompaun pubchem, u.S. Perpustakaan Perubatan Negara. Terdapat di sini
Ihsan gambar:
1.'Shell Electron 029 Tembaga' (CC BY-SA 2.0 uk) melalui Commons Wikimedia


