Perbezaan antara reaksi yang ditambah dan tidak digagalkan
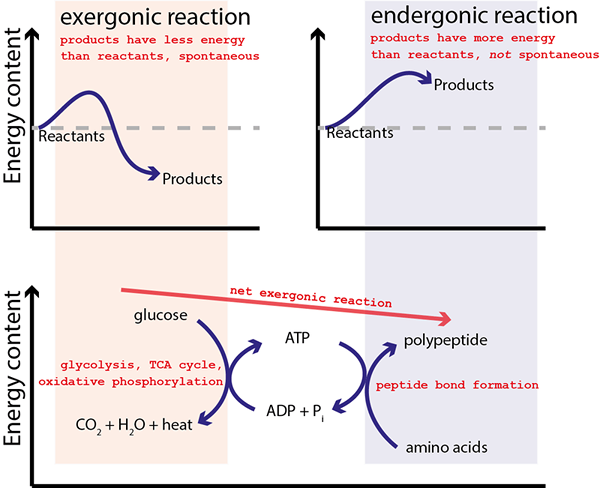
The Perbezaan utama antara reaksi yang ditambah dan tidak digagalkan ialah Reaksi yang ditambah menunjukkan tenaga pemindahan dari satu sisi tindak balas ke sisi lain manakala tindak balas yang tidak digagalkan tidak melibatkan pemindahan tenaga.
Sebilangan besar tindak balas kimia yang kita tahu adalah endergonik, yang bermaksud reaksi tidak spontan. Oleh itu, tenaga bebas gibbs tindak balas ini lebih tinggi daripada sifar. Reaksi ini memerlukan tenaga dari persekitaran luaran untuk berlaku reaksi. Oleh itu, kita boleh pasangan reaksi ini dengan tindak balas exergonik yang berasingan yang "memandu" reaksi bukan spontan. Kedua -dua tindak balas yang ditambah ini sering berkongsi keadaan pertengahan.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu reaksi yang digabungkan
3. Apa itu reaksi yang tidak digagalkan
4. Perbandingan sampingan - ditambah dengan tindak balas yang tidak digagalkan dalam bentuk jadual
5. Ringkasan
Apa itu reaksi yang digabungkan?
Reaksi yang ditambah adalah tindak balas kimia yang mempunyai keadaan perantaraan untuk proses pemindahan tenaga. Dalam erti kata lain, reaksi ini terbentuk dari gabungan dua reaksi yang berbeza di mana terdapat keadaan perantaraan biasa di mana tenaga dipindahkan dari satu sisi reaksi ke sisi lain.
Sebilangan besar tindak balas kimia yang kita tahu adalah endergonic (bukan spontan). Oleh itu, tindak balas ini memerlukan bekalan tenaga untuk reaksi berlaku. Untuk tujuan ini, tindak balas bukan spontan dapat ditambah dengan tindak balas kimia lain yang dapat membekalkan tenaga untuk "memandu" reaksi bukan spontan. Reaksi kimia awal adalah termodinamik tidak menguntungkan, dan selepas proses gandingan, ia menjadi termodinamik yang baik. Kedua -dua reaksi disatukan melalui keadaan perantaraan yang biasa berlaku untuk kedua -dua reaksi. Kemudian tenaga Gibbs untuk setiap reaksi separuh dapat disimpulkan untuk menghasilkan tenaga bebas gibbs gabungan untuk reaksi yang digabungkan.

Rajah 01: Reaksi digabungkan
Contoh umum tindak balas yang ditambah ialah pembentukan ATP, yang merupakan proses endergonik, dan ia ditambah pula dengan pelesapan kecerunan proton.
Apa itu reaksi yang tidak digagalkan?
Reaksi yang tidak digagalkan adalah tindak balas kimia yang tidak mempunyai keadaan pertengahan untuk pemindahan tenaga. Contoh untuk tindak balas yang tidak digagalkan ialah reaksi gabungan glukosa dan fruktosa untuk membentuk sukrosa. Reaksi ini termodinamik tidak menguntungkan kerana memerlukan tenaga yang tinggi.
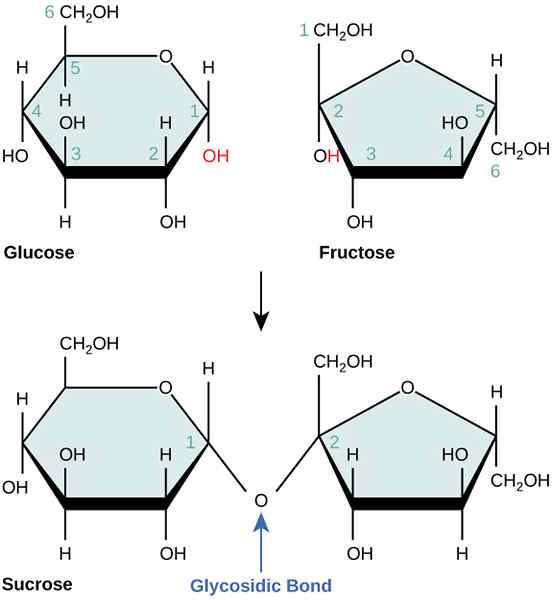
Rajah 02: Gabungan glukosa dan fruktosa untuk membentuk sukrosa
Walau bagaimanapun, jika kita pasangan tindak balas ini dengan tindak balas hidrolisis ATP, maka tindak balas itu mungkin dan berlaku dalam dua langkah yang baik, berkongsi keadaan pertengahan yang sama. Kemudian ia menjadi tindak balas yang digabungkan.
Apakah perbezaan antara reaksi yang ditambah dan tidak digagalkan?
Kebanyakan tindak balas kimia yang kita tahu adalah bukan spontan; Oleh itu, kita perlu pasangan mereka dengan beberapa reaksi lain untuk menjadikannya kemajuan. Oleh itu, jenis tindak balas baru ini dipanggil tindak balas yang ditambah manakala jenis tindak balas bukan spontan sebelumnya dipanggil reaksi yang tidak digagalkan. Perbezaan utama antara tindak balas yang ditambah dan tidak digabungkan ialah tindak balas yang ditambah menunjukkan tenaga pemindahan dari satu sisi tindak balas ke sisi lain sedangkan dalam reaksi yang tidak digagalkan tidak ada pemindahan tenaga yang berlaku.
Di bawah infographic tabulates lebih banyak perbezaan antara reaksi yang ditambah dan tidak digagalkan.
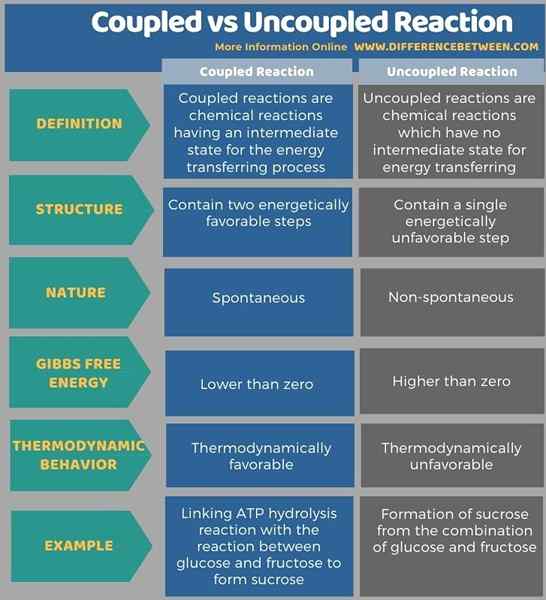
Ringkasan -ditambah dengan reaksi yang tidak digagalkan
Kebanyakan tindak balas kimia yang kita tahu adalah bukan spontan; Oleh itu, kita perlu pasangan mereka dengan beberapa reaksi lain untuk menjadikannya kemajuan. Jenis tindak balas baru ini dipanggil tindak balas yang ditambah manakala jenis tindak balas bukan spontan sebelumnya dipanggil reaksi yang tidak digagalkan. Perbezaan utama antara tindak balas yang ditambah dan tidak digabungkan ialah tindak balas yang ditambah menunjukkan tenaga pemindahan dari satu sisi tindak balas ke sisi lain sedangkan dalam reaksi yang tidak digagalkan tidak ada pemindahan tenaga yang berlaku.
Rujukan:
1. "7.7: Reaksi berganda."Kimia Libretexts, Libretexts, 11 Ogos. 2020, boleh didapati di sini.
Ihsan gambar:
1. "Reaksi Berganda" oleh Muessig - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia
2. "Rajah 03 02 04" oleh CNX OpenStax - (CC oleh 4.0) melalui Commons Wikimedia


