Perbezaan antara sifat koligatif elektrolit dan nonelektrik
Perbezaan utama - Colligative Sifat elektrolit vs nonelectrolytes
Ciri -ciri koligatif adalah sifat fizikal penyelesaian yang bergantung pada jumlah larut tetapi tidak pada sifat larut. Ini bermakna jumlah yang sama dengan larutan yang sama sekali berbeza dapat mengubah sifat fizikal ini dalam kuantiti yang sama. Oleh itu, sifat colligative bergantung pada nisbah jumlah larut dan jumlah pelarut. Tiga sifat koligatif utama adalah penurunan tekanan wap, ketinggian titik mendidih dan kemurungan titik beku. Untuk nisbah jisim pelarut yang diberikan, semua sifat koligatif berkadar songsang dengan larut jisim molar. Elektrolit adalah bahan yang boleh membentuk penyelesaian yang dapat menjalankan elektrik melalui penyelesaian ini. Penyelesaian sedemikian dikenali sebagai penyelesaian elektrolitik. Nonelectrolytes adalah bahan yang tidak mampu membentuk penyelesaian elektrolitik. Kedua -dua jenis ini (elektrolit dan nonelectrolytes) mempunyai sifat koligatif. The Perbezaan utama antara sifat koligatif elektrolit dan nonelektrik adalah bahawa Kesan elektrolit pada sifat koligatif sangat tinggi berbanding dengan nonelektrik.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah sifat koligatif elektrolit
3. Apakah sifat koligatif nonelectrolytes
4. Perbandingan sampingan - Ciri -ciri Colligative Electrolytes vs Nonelectrolytes dalam Bentuk Tabular
5. Ringkasan
Apakah sifat koligatif elektrolit?
Ciri -ciri koligatif elektrolit adalah sifat fizikal penyelesaian elektrolitik yang bergantung kepada jumlah larutan tanpa mengira sifat larutan. Larutan yang terdapat dalam penyelesaian elektrolitik adalah atom, molekul atau ion yang mempunyai elektron yang hilang atau diperoleh untuk menjadi konduktif elektrik.
Apabila elektrolit dibubarkan dalam pelarut seperti air, elektrolit memisahkan ke dalam ion (atau mana -mana spesies konduktif lain). Oleh itu, membubarkan satu tahi lalat elektrolit selalu menghasilkan dua atau lebih mol spesies konduktif. Oleh itu, sifat koligatif elektrolit berubah jauh apabila elektrolit dibubarkan dalam pelarut.
Sebagai contoh, persamaan umum yang digunakan dalam menggambarkan titik pembekuan dan perubahan titik mendidih adalah seperti berikut,
Δtb = Kbm dan Δtf = Kfm
Δtb adalah ketinggian titik mendidih, dan ΔTf adalah kemurungan titik beku. Kb dan kf adalah titik ketinggian titik mendidih dan pembekuan titik pembekuan masing -masing. m adalah molariti penyelesaiannya. Untuk penyelesaian elektrolitik, persamaan di atas diubahsuai seperti berikut,
Δtb = IKbm dan Δtf = IKfm
"I" adalah pengganda ion yang dikenali sebagai Van't Hoff Factor. Faktor ini sama dengan bilangan tahi lalat ion yang diberikan oleh elektrolit. Oleh itu, faktor van't hoff dapat ditentukan dengan mencari bilangan ion yang dikeluarkan oleh elektrolit apabila ia dibubarkan dalam pelarut. Sebagai contoh, nilai faktor van't hoff untuk NaCl adalah 2 dan dalam CACL2, ia adalah 3.

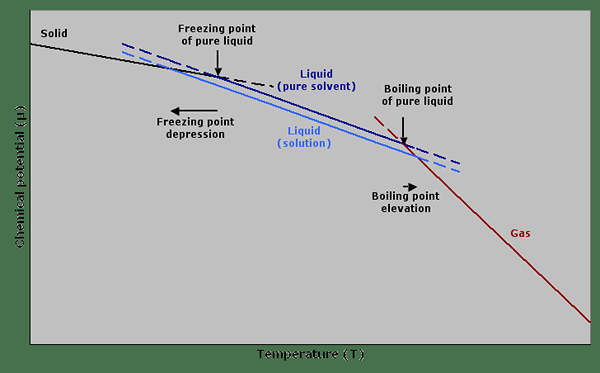
Rajah 01: Graf yang menunjukkan potensi kimia terhadap suhu yang menggambarkan kemurungan titik beku dan ketinggian titik mendidih
Walau bagaimanapun, nilai yang diberikan untuk sifat -sifat koligatif ini berbeza daripada nilai yang diramalkan secara teoritis. Itu kerana terdapat interaksi larut dan pelarut yang mengurangkan kesan ion pada sifat -sifat tersebut.
Persamaan di atas diubah suai selanjutnya digunakan untuk elektrolit yang lemah. Elektrolit yang lemah sebahagiannya memisahkan ke dalam ion, oleh itu beberapa ion tidak mempengaruhi sifat koligatif. Tahap pemisahan (α) elektrolit yang lemah dapat dikira seperti berikut,
α = (i-1)/(n-1) x 100
Di sini, n ialah bilangan maksimum ion yang dibentuk setiap molekul elektrolit yang lemah.
Apakah sifat koligatif nonelectrolytes?
Ciri-ciri koligatif nonelektrik adalah sifat fizikal penyelesaian bukan elektrolitik yang bergantung kepada jumlah larutan tanpa mengira sifat larutan. Bukan elektrolit adalah bahan yang tidak menghasilkan penyelesaian konduktif apabila dibubarkan dalam pelarut. Sebagai contoh, gula adalah nonelectrolyte kerana apabila gula dibubarkan di dalam air, ia wujud dalam bentuk molekul (tidak memisahkan ion). Molekul gula ini tidak mampu menjalankan arus elektrik melalui penyelesaian.
Bilangan larutan yang terdapat dalam larutan bukan elektrolitik kurang berbanding dengan larutan elektrolitik. Oleh itu, kesan nonelectrolytes pada sifat koligatif juga sangat rendah. Sebagai contoh, tahap tekanan wap menurunkan dengan menambahkan NaCl lebih tinggi berbanding penambahan gula kepada penyelesaian yang sama.
Apakah perbezaan antara sifat koligatif elektrolit dan nonelektrik?
Ciri -ciri Colligative Electrolytes vs Nonelectrolytes | |
| Ciri -ciri koligatif elektrolit adalah sifat fizikal penyelesaian elektrolitik yang bergantung kepada jumlah larutan tanpa mengira sifat larutan. | Ciri-ciri koligatif nonelektrik adalah sifat fizikal penyelesaian bukan elektrolitik yang bergantung kepada jumlah larutan tanpa mengira sifat larutan. |
| Larutan | |
| Elektrolit memberikan lebih banyak larutan kepada penyelesaian melalui pemisahan; Oleh itu, sifat colligative banyak berubah. | Nonelectrolytes memberikan larutan yang rendah kepada larutan kerana tidak ada pemisahan; Oleh itu, sifat colligative tidak banyak berubah. |
| Kesan pada sifat koligatif | |
| Kesan elektrolit pada sifat koligatif sangat tinggi berbanding dengan nonelektrik. | Kesan nonelectrolytes pada sifat koligatif sangat rendah berbanding dengan elektrolit. |
Ringkasan - Colligative Sifat elektrolit vs nonelectrolytes
Ciri -ciri koligatif adalah sifat fizikal penyelesaian yang tidak bergantung pada sifat larut tetapi jumlah larutan. Perbezaan antara sifat koligatif elektrolit dan nonelektrik adalah bahawa kesan elektrolit pada sifat koligatif sangat tinggi berbanding dengan nonelektrik.
Rujukan:
1."5.9: Ciri -ciri Colligative Penyelesaian Elektrolit."Kimia Libretexts, Libretexts, 21 Julai 2016. Terdapat di sini
2."Ciri -ciri Colligative."Wikipedia, Yayasan Wikimedia, 10 Mar. 2018. Terdapat di sini
3.Britannica, editor Encyclopaedia. "Elektrolit."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 7 Jun 2017. Terdapat di sini
Ihsan gambar:
1.'Kemurungan titik pembekuan dan ketinggian titik mendidih'by tomas er - kerja sendiri, (cc by -sa 3.0) melalui Commons Wikimedia


