Perbezaan antara butana dan isobutane

Butane vs Isobutane
Molekul organik adalah molekul yang terdiri daripada karbon. Hidrokarbon adalah molekul organik, yang terdiri daripada hanya atom karbon dan hidrogen. Hidrokarbon boleh menjadi aromatik atau alifatik. Mereka terutamanya dibahagikan kepada beberapa jenis seperti Alkanes, Alkenes, Alkynes, Cycloalkanes dan Aromatic Hydrocarbons. Heksana dan n-heksana adalah alkana atau sebaliknya, dikenali sebagai hidrokarbon tepu. Mereka mempunyai bilangan atom hidrogen tertinggi, yang mana molekul dapat menampung. Semua ikatan antara atom karbon dan hidrogen adalah ikatan tunggal. Kerana itu, putaran ikatan dibenarkan di antara mana -mana atom. Mereka adalah jenis hidrokarbon yang paling mudah. Hidrokarbon tepu mempunyai formula umum cnH2n+2. Keadaan ini sedikit berbeza untuk sikloalkanes kerana mereka mempunyai struktur kitaran.
Butana
Seperti yang dinyatakan di atas, hidrokarbon butana adalah alkana tepu. Ia mempunyai empat atom karbon; Oleh itu, mempunyai formula molekul c4H10. Jisim molar butana adalah 58.12 g mol-1. Titik lebur butana adalah 133-139 K, dan titik mendidih ialah 272-274 k. Butane adalah nama biasa yang digunakan untuk menunjukkan semua molekul dengan formula ini. Terdapat dua isomer struktur yang boleh kita lukis untuk memadankan formula ini tetapi, dalam tatanama IUPAC, kita menggunakan butana khusus untuk menunjukkan molekul tidak bercabang, yang juga dikenali sebagai n-butan. Ia mempunyai struktur berikut.

Isomer struktur lain adalah seperti molekul methylated propana. Ia dikenali sebagai isobutane. Butana adalah gas tidak berwarna. Ia boleh dengan mudah dicairkan. Gas butana sangat mudah terbakar. Butane adalah komponen gas asli, dan ia dihasilkan apabila petrol ditapis. Setelah pembakaran lengkap, butana menghasilkan karbon dioksida dan air. Walau bagaimanapun, jika tidak ada gas oksigen yang mencukupi untuk pembakaran, ia menghasilkan karbon monoksida dan air dari pembakaran separa. Butane digunakan sebagai bahan bakar. Semasa menghasilkan gas LP, butana bercampur dengan propana dan hidrokarbon lain. Ini digunakan untuk tujuan memasak di rumah tangga. Ia juga digunakan dalam pemetik api.
Isobutane
Isobutane adalah isomer struktur butana. Ia mempunyai formula molekul yang sama seperti butana, tetapi formula strukturnya berbeza. Ia juga dikenali sebagai metilpropane. Ia mempunyai struktur berikut.
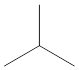
Isobutane mempunyai karbon tertiari, dan ia adalah molekul paling mudah dengan karbon tertiari. Isobutane adalah gas yang tidak berwarna, tidak berbau, telus. Titik lebur isobutane adalah 40-240 K, dan titik mendidih ialah 260-264 k. Ia digunakan terutamanya sebagai penyejuk. Bentuk isobutane tulen digunakan dalam peti sejuk. Selanjutnya, ia digunakan sebagai propelan dalam semburan aerosol.
| Apakah perbezaan antara butana dan isobutane? • isobutane adalah isomer struktur butana. • butana tidak bercabang, dan isobutane bercabang. • Kedua -duanya mempunyai formula molekul yang sama, tetapi formula struktur berbeza. • Butane mempunyai empat atom karbon dalam rantai lurus, sedangkan isobutane hanya mempunyai tiga atom karbon dalam rantai lurus. • Sifat fizikal butana dan isobutane berbeza. Sebagai contoh, mereka mempunyai titik lebur yang berbeza, titik mendidih, ketumpatan, dan lain -lain. • Isobutane tulen digunakan terutamanya sebagai penyejuk |


