Perbezaan antara ligan bidentate dan ambidentate
Perbezaan utama - bidentate vs Ambidentate Ligan
The Perbezaan utama antara ligan bidentate dan ambidentate adalah Ligan Bidentate boleh mengikat atom pusat melalui dua ikatan pada masa yang sama manakala ligan ambidentate boleh membentuk dua ikatan dengan atom pusat, tetapi hanya membentuk satu ikatan pada satu masa.
Ligan adalah molekul atau anion yang kaya dengan elektron yang boleh mendermakan pasangan elektron tunggal ke atom yang mempunyai cas elektrik positif. Terdapat beberapa jenis ligan yang dinamakan sebagai ligan monodentate, ligan bidentate, ligan polydentate, dll. Berdasarkan bilangan ikatan yang dapat mereka bentuk dengan atom.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah ligan bidentate
3. Apa itu ligan ambidentate
4. Persamaan antara ligan bidentate dan ambidentate
5. Perbandingan sampingan - bidentate vs ligan ambidentate dalam bentuk jadual
6. Ringkasan
Apakah ligan bidentate?
Ligan bidentate adalah molekul atau anion yang boleh mengikat atom melalui dua ikatan kovalen koordinat. Menyelaras ikatan kovalen adalah sejenis ikatan kovalen yang terbentuk apabila spesies kimia kaya elektron menyumbangkan pasangan elektron tunggal kepada spesies kimia kekurangan elektron seperti atom logam yang dikenakan secara positif. Apabila ligan dan kation mengikat dengan cara ini, sebatian koordinasi terbentuk. Atom yang mana ligan terikat dipanggil Pusat Penyelarasan.
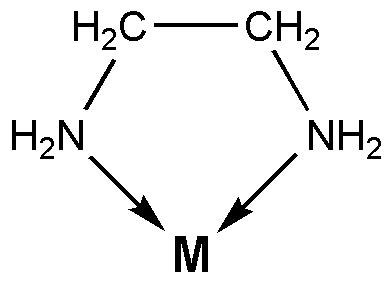
Rajah 01: Ethylenediamine adalah ligan bidentate
Ligan bidentate mempunyai dua atom penderma. Ini bermakna, terdapat dua atom yang boleh mendermakan pasangan elektron tunggal mereka. Beberapa contoh biasa untuk ligan bidentate termasuk ion oksalat (c2O42-) yang mempunyai dua atom oksigen sebagai atom penderma dan etilenediamin (c₂h₄ (nh₂) ₂) yang mempunyai dua atom nitrogen sebagai atom penderma.
Apa itu ligan ambidentate?
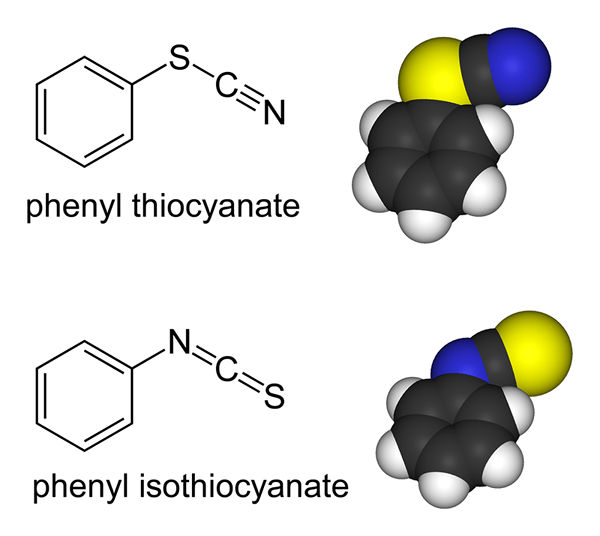
Ligan ambidentate adalah molekul atau ion yang mempunyai dua atom penderma tetapi mampu mengikat dengan atom melalui hanya satu atom penderma pada satu masa. Contoh ligan ambidentate termasuk ion thiocyanate (SCN-) di mana kedua -dua atom sulfur dan atom nitrogen mampu menderma pasangan elektron tunggal. Tetapi sama ada atom sulfur atau atom nitrogen boleh mengikat ke pusat koordinasi pada satu masa.

Rajah 02: Thiocyanate adalah ligan ambidentate
Contoh lain ialah ion nitrat (tidak2-) di mana atom nitrogen dan atom oksigen boleh menjadi atom penderma.
Apakah persamaan antara ligan bidentate dan ambidentate?
- Kedua -dua ligan bidentate dan ambidentate mempunyai dua atom penderma.
- Kedua -dua ligan mempunyai sekurang -kurangnya dua atom dengan pasangan elektron tunggal.
Apakah perbezaan antara ligan bidentate dan ambidentate?
Bidentate vs Ligan Ambidentate | |
| Ligan bidentate adalah molekul atau anion yang boleh mengikat atom melalui dua ikatan kovalen koordinat. | Ligan ambidentate adalah molekul atau ion yang mempunyai dua atom penderma tetapi mampu mengikat dengan atom melalui hanya satu atom penderma pada satu masa. |
| Pembentukan bon | |
| Ligan bidentate mampu membentuk dua ikatan kovalen koordinat pada satu masa. | Ligan ambidentate mampu membentuk satu ikatan kovalen koordinat pada satu masa. |
| Contoh | |
| Contoh ligan bidentate termasuk ion etilenediamin dan oksalat. | Contoh ligan ambidentate termasuk ion thiocyanate dan ion nitrat. |
Ringkasan - Bidentate vs Ambidentate Ligan
Ligan adalah molekul atau ion yang boleh mengikat dengan atom kekurangan elektron melalui koordinat ikatan kovalen. Ligan bidentate dan ligan ambidentate adalah dua bentuk ligan seperti. Perbezaan antara ligan bidentate dan ambidentate adalah bahawa ligan bidentate dapat mengikat dengan atom pusat melalui dua ikatan pada masa yang sama manakala ligan ambidentate mampu membentuk dua ikatan dengan atom pusat tetapi hanya satu ikatan pada satu masa pada satu masa.
Rujukan:
1. "Ligands | Jenis Ligan | Chelate Ligand, Dengentiti, Ambidentate Ligand | Kimia | Byju's."Kimia, kelas Byjus, 8 mar. 2018. Terdapat di sini
2. Libretexts. "Ligan."Kimia Libretexts, Libretexts, 19 Jan. 2018. Terdapat di sini
Ihsan gambar:
1.'M-en'by tiada pengarang yang boleh dibaca mesin yang disediakan (domain awam) melalui Wikimedia Commons
2.'Phscn-phncs-comparison' (domain awam) melalui Commons Wikimedia


