Perbezaan antara autoionisasi dan autoprotolisis
The Perbezaan utama Antara autoionisasi dan autoprotolisis ialah Autoionisasi adalah penukaran keadaan neutral spesies kimia ke dalam keadaan terionisasi manakala autoprotolisis adalah pemindahan proton antara dua spesies kimia yang sama untuk membentuk bentuk terionisasi.
Kedua -dua istilah autoionisasi dan autoprotolisis Huraikan dua kaedah pembentukan spesies terionisasi, i.e. kation dan anion. Ini adalah tindak balas spontan di mana pengionan berlaku tanpa kesan faktor luaran.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu autoionisasi
3. Apakah autoprotolisis
4. Perbandingan sampingan - autoionisasi vs autoprotolisis dalam bentuk tabular
5. Ringkasan
Apa itu autoionisasi?
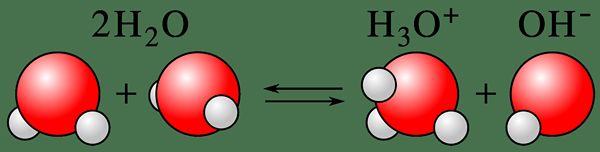
Autoionisasi adalah proses menukar keadaan neutral spesies kimia ke dalam keadaan terionisasi. Istilah biasanya menggambarkan pengionan molekul air. Oleh itu, kita boleh menyebutnya sama ada pengionan air atau pembubaran auto air juga. Di sini, molekul air menusuk untuk membentuk ion hidroksida, OH- dan ion hidrogen, h+ (proton). Di sini, deprotonasi segera menonjolkan molekul air yang lain dan membawa kepada pembentukan ion hidronium (H3O+). Oleh itu, proses ini adalah contoh yang baik dari sifat air amphoterik.

Rajah 01: Pengukuran diri molekul air
Selanjutnya, proses ini menerangkan sifat air amphoterik. Sifat amphoterik bermakna air boleh bertindak sebagai asid dan asas kerana autoionisasi membentuk kedua -dua proton dan ion hidroksida, yang memberikan air keupayaan untuk meneutralkan kedua -dua asid dan asas sedikit sebanyak; Contohnya, ion hidronium atau h3O+ Ion dapat meneutralkan pangkalan ringan, dan ion hidroksida dapat meneutralkan asid ringan.
Apakah autoprotolisis?
Autoprotolisis adalah proses pemindahan proton antara spesies kimia yang sama untuk membentuk spesies terionisasi. Di sini, salah satu daripada dua molekul yang sama bertindak sebagai asid Brønsted, dan ia melepaskan proton. Molekul lain dapat menerima proton ini. Oleh itu, molekul lain ini bertindak sebagai pangkalan Brønsted. Pengionan air adalah contoh untuk autoprotolisis. Tambahan pula, istilah ini berbeza daripada autoprotonolisis kerana autoprotonolisis menggambarkan belahan ikatan kimia oleh asid.
Beberapa contoh lain dari sebatian kimia yang menjalani autoprotolisis termasuk ammonia dan asid asetik;
Autoprotolisis ammonia:
2nh3 ⇌ nh2- + NH4+
Autoprotolisis asid asetik:
2ch3COOH ⇌ CH3COO- + Ch3COOH2+
Apakah perbezaan antara autoionisasi dan autoprotolisis?
Kedua -dua autoionisasi dan autoprotolisis adalah tindak balas spontan. Perbezaan utama antara autoionisasi dan autoprotolisis ialah autoionisasi adalah penukaran keadaan neutral spesies kimia ke dalam keadaan terionisasi manakala autoprotolisis adalah pemindahan proton antara dua spesies kimia yang sama untuk membentuk bentuk terionisasi. Contoh autoionisasi adalah air manakala air, ammonia, asid asetik adalah beberapa contoh untuk autoprotolisis.
Selain itu, dalam proses autoionisasi (juga dikenali sebagai pengionan air atau disosiasi auto), molekul air deprotonates untuk membentuk ion hidroksida, OH- dan ion hidrogen, H+ (proton), semasa dalam proses proses Autoprotolisis, salah satu daripada dua molekul yang sama melibatkan tindakan sebagai asid Brønsted dan ia melepaskan proton yang diterima oleh molekul lain yang bertindak sebagai pangkalan Brønsted. Tambahan pula, proses autoionisasi air menerangkan sifat amphoterik (ia dapat meneutralkan kedua -dua asid ringan dan pangkalan ringan) air. Sebaliknya, autoprotolisis menerangkan sifat amphoterik sebatian kimia seperti air, asid asetik dan ammonia.
Infographic di bawah meringkaskan perbezaan antara autoionisasi dan autoprotolisis.
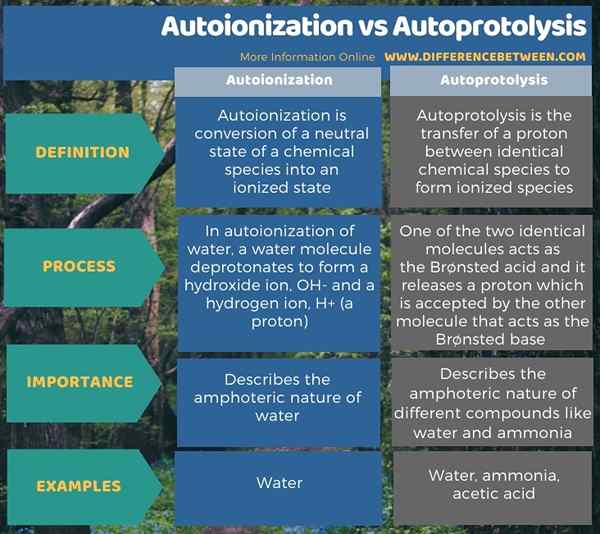
Ringkasan -autoionisasi vs autoprotolisis
Kedua -dua autoionisasi dan autoprotolisis adalah tindak balas spontan. Perbezaan utama antara autoionisasi dan autoprotolisis ialah autoionisasi adalah penukaran keadaan neutral spesies kimia ke dalam keadaan terionisasi manakala autoprotolisis adalah pemindahan proton antara dua spesies kimia yang sama untuk membentuk bentuk terionisasi.
Rujukan:
1. "Pengionan air sendiri."Wikipedia, Yayasan Wikimedia, 3 Jun 2019, boleh didapati di sini.
2. "Autoprotolisis."Wikipedia, Yayasan Wikimedia, 24 Sept. 2019, boleh didapati di sini.
3. "Autoionisasi air."Kimia Libreetexts, Libretexts, 5 Jun 2019, boleh didapati di sini.
Ihsan gambar:
1. "Autoprotolyse Eau" oleh Cdang - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


