Perbezaan antara anion dan kation
The Perbezaan utama antara anion dan kation adalah bahawa Anion adalah ion yang dikenakan negatif yang terbentuk daripada atom neutral manakala kation adalah ion yang dikenakan secara positif dari atom neutral.
Biasanya, anion dan kation dipanggil ion. Atom pelbagai elemen tidak stabil (kecuali gas mulia) dalam keadaan normal. Untuk menjadi stabil, mereka menjalani pelbagai perubahan kimia terutamanya mengenai bilangan elektron. Sebagai contoh, mereka boleh mengeluarkan atau mendapatkan elektron atau berkongsi elektron untuk mendapatkan konfigurasi elektron yang stabil. Apabila ini berlaku, unsur -unsur cenderung bergabung dengan unsur -unsur lain. Unsur -unsur kimia dapat bergabung antara satu sama lain untuk membentuk sebatian kimia. Unsur -unsur mengikat antara satu sama lain melalui ikatan kimia yang mempunyai ciri -ciri ionik atau kovalen. Sekiranya sebatian mempunyai ikatan ionik, mereka dikenali sebagai sebatian ionik. Sebatian ionik terbentuk oleh tarikan antara ion positif dan negatif.

Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Anion
3. Apa itu kation
4. Perbandingan sampingan - Anion vs kation dalam bentuk jadual
5. Ringkasan
Apa itu Anion?
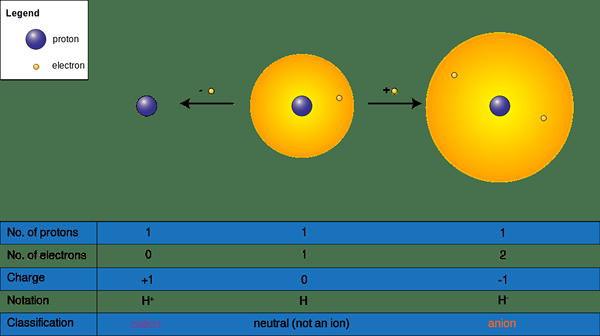
Anion adalah ion yang dicas negatif yang terbentuk dari atom neutral. Apabila atom menarik satu atau lebih elektron ke orbital luarnya, bentuk ion negatif. Dalam atom neutral, bilangan elektron di kulit luar bersamaan dengan bilangan proton dalam nukleus. Elektron zarah subatomik yang dikenakan secara negatif, dan proton zarah subatomik positif. Oleh kerana nombornya sama, atom tidak mempunyai caj bersih.
Walau bagaimanapun, apabila atom menarik lebih banyak elektron dari luar, bilangan elektron meningkat, oleh itu atom menjadi negatif. Untuk menarik elektron, harus ada beberapa spesies lain, yang dengan mudah memberikan elektron kepada atom anionik. Menurut bilangan elektron yang diperoleh, saiz caj berbeza. Sebagai contoh, jika atom memperoleh satu elektron, bentuk anion monovalen dan jika ia memperoleh dua elektron dalam bentuk anion divalen.

Rajah 01: Pembentukan ion
Biasanya, anion terbentuk oleh unsur bukan logam, yang berada di blok P jadual berkala. Sebagai contoh, nitrogen membentuk anion -3 anion; oksigen membentuk anion -2 anion dan klorin membentuk anion -1 anion. Atom ini lebih elektronegatif, oleh itu dapat menarik elektron dan membentuk anion. Bukan sahaja atom tunggal, tetapi terdapat beberapa atom atau molekul yang membentuk jenis ion ini. Di samping itu, jika anion hanya atom, ia dikenali sebagai anion monoatomik. Jika anion mempunyai beberapa atom, atau jika ia adalah molekul, ia dikenali sebagai anion polyatomik. Selain itu, ion -ion ini menarik ke medan elektrik yang positif atau spesies yang dikenakan positif.
Apa itu kation?
Kation adalah ion yang dicas secara positif. Bentuk ion ini apabila atom neutral menghilangkan satu atau lebih elektron. Apabila mereka mengeluarkan elektron, bilangan proton dalam nukleus lebih tinggi daripada bilangan elektron dalam cangkang luar; Oleh itu, atom mendapat caj positif.
Bentuk kation dari logam di blok S, logam peralihan, lanthanides dan actinides, dll. Seperti anion, kation juga boleh mempunyai pelbagai saiz caj bergantung kepada bilangan elektron yang dikeluarkan. Oleh itu, mereka membentuk monovalen (na+), divalen (ca2+), dan trivalen (al3+) kation. Di samping itu, terdapat kation monoatomik atau polyatomik (NH4+).
Apakah perbezaan antara anion dan kation?
Anion vs kation | |
| Ion dicas negatif yang terbentuk dari atom neutral. | Ion dicas positif yang terbentuk dari atom neutral. |
| Pembentukan | |
| Bentuk anion dengan menarik elektron. | Bentuk kation dengan mengeluarkan elektron. |
| Spesies kimia | |
| Bukan logam terutamanya membuat anion. | Logam membuat kation. |
| Tarikan ke medan elektrik | |
| Menarik ke hujung positif medan elektrik. | Menarik ke hujung negatif medan elektrik. |
Ringkasan -Anion vs kation
Anion dan kation adalah bentuk spesies kimia yang dikenakan. Perbezaan antara anion dan kation adalah bahawa anion adalah ion yang dikenakan negatif yang terbentuk dari atom neutral manakala kation adalah ion dicas secara positif yang terbentuk daripada atom neutral.
Rujukan:
1. Helmenstine, Todd. "Perbezaan antara kation dan anion."Thoughtco, Feb. 1, 2018. Terdapat di sini
2. "Ion."Wikipedia, Yayasan Wikimedia, 14 Mei 2018. Terdapat di sini
Ihsan gambar:
1.'Ion'by jkwchui - kerja sendiri, (cc by -sa 3.0) melalui Commons Wikimedia


