Perbezaan antara asid dan alkali
The Perbezaan utama antara asid dan alkali ialah pH asid terletak di bawah pH 7 manakala pH alkali berada di atas pH 7.
Asid dan pangkalan adalah dua konsep penting dalam kimia. Mereka mempunyai sifat yang bercanggah. Alkali adalah subset pangkalan. Oleh itu, ia mempunyai semua ciri asas. Selain itu, terdapat pelbagai kaedah untuk membezakan antara asid dan alkali yang akan kita bincangkan di bawah.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu asid
3. Apa itu alkali
4. Perbandingan sampingan - asid vs alkali dalam bentuk jadual
5. Ringkasan
Apa itu asid?
Terdapat beberapa definisi untuk asid dari saintis yang berbeza. Arrhenius mentakrifkan asid sebagai bahan yang menyumbangkan h3O+ ion dalam penyelesaian. Sedangkan, bronsted-lowry mentakrifkan asid sebagai bahan yang dapat mendermakan proton. Walau bagaimanapun, definisi asid Lewis jauh lebih biasa daripada dua di atas. Menurutnya, mana -mana penerima pasangan elektron adalah asid. Menurut definisi Arrhenius atau Bronsted-Lowry, sebatian, untuk menamakannya sebagai asid, harus mempunyai hidrogen dan keupayaan untuk mendermakannya sebagai proton. Tetapi menurut Lewis, terdapat molekul, yang tidak mempunyai hidrogen tetapi boleh bertindak sebagai asid. Contohnya, bcl3 adalah asid Lewis, kerana ia boleh menerima pasangan elektron. Alkohol adalah asid Bronsted-Lowry kerana ia boleh mendermakan proton, namun menurut Lewis, ia adalah asas.

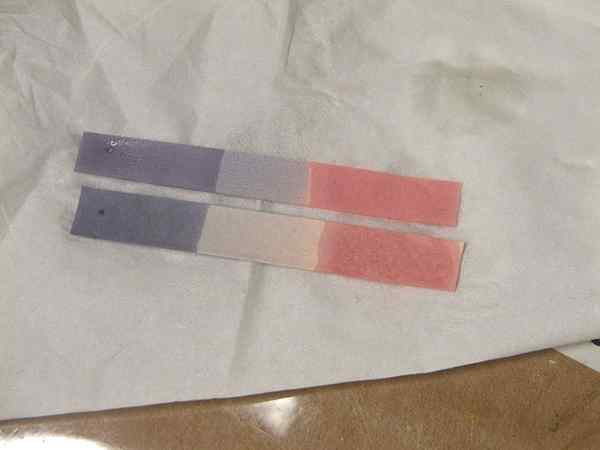
Rajah 01: Warna litmus untuk asid dan pangkalan
Tidak kira definisi di atas, biasanya kita mengenal pasti asid sebagai penderma proton. Asid mempunyai rasa masam. Jus limau, cuka adalah dua asid yang kita jumpai di rumah kita. Mereka bertindak balas dengan pangkalan yang menghasilkan air, dan juga mereka bertindak balas dengan logam untuk membentuk H2, dengan itu meningkatkan kadar kakisan logam. Kita boleh mengkategorikan asid menjadi dua kelas, bergantung kepada keupayaan mereka untuk memisahkan dan menghasilkan proton. Mereka adalah asid kuat dan asid lemah.
Asid kuat dan asid lemah
Asid kuat seperti HCl, HNO3 boleh mengionkan sepenuhnya penyelesaian untuk memberi proton. Asid lemah seperti CH3COOH boleh memisahkan sebahagiannya untuk memberikan lebih sedikit proton. Ka adalah pemisahan asid yang berterusan. Ia memberikan petunjuk keupayaan untuk kehilangan proton asid lemah. Untuk memeriksa sama ada bahan adalah asid atau tidak kita boleh menggunakan beberapa petunjuk seperti kertas litmus atau kertas pH. Dalam skala pH dari 1-6 asid diwakili (di bawah pH 7). Asid dengan pH 1 adalah sangat kuat dan apabila nilai pH meningkat, keasidan menurun. Selain itu, asid menjadikan litmus biru menjadi merah.
Apa itu alkali?
Alkali mempunyai pH di atas 7. Oleh itu, pH bahan alkali terletak di atas pH 7. Kumpulan 1 dan kumpulan 2 elemen, yang kita namakan sebagai logam alkali dan logam bumi alkali adalah bahan alkali biasa, dan mereka memberikan penyelesaian alkali ketika kita membubarkannya di dalam air. Natrium hidroksida, kalium hidroksida, magnesium hidroksida, kalsium karbonat adalah beberapa contoh bahan alkali ini.
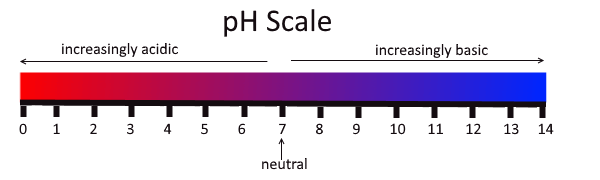
Rajah 02: Asid dan pangkalan dalam skala pH
Arrhenius mentakrifkan pangkalan sebagai bahan yang menghasilkan oh- dalam penyelesaian. Molekul di atas membentuk OH- Apabila kita membubarkannya di dalam air, oleh itu, bertindak sebagai pangkalan. Penyelesaian alkali bertindak balas dengan mudah dengan asid yang menghasilkan molekul air dan garam. Mereka menunjukkan nilai pH lebih tinggi daripada 7 dan menjadikan litmus merah menjadi biru. Terdapat pangkalan lain kecuali pangkalan alkali seperti NH3. Mereka juga mempunyai sifat asas yang sama.
Apakah perbezaan antara asid dan alkali?
Asid dan Alkali adalah dua bentuk sebatian yang kita mengkategorikan mengikut pH mereka. Oleh itu, perbezaan utama antara asid dan alkali ialah pH asid terletak di bawah pH 7 manakala pH alkali berada di atas pH 7. Selain itu, asid boleh mengion untuk membentuk proton atau h+ ion manakala sebatian alkali dapat mengion untuk membentuk ion hidroksida. Apabila mempertimbangkan rasa dan tekstur kedua -dua sebatian tersebut, kita boleh mendapatkan perbezaan lain antara sebatian asid dan alkali. Iaitu asid rasa masam dan mempunyai perasaan melekit sementara alkali rasa pahit dan mempunyai perasaan licin.
Infographic di bawah meringkaskan perbezaan antara asid dan alkali dalam bentuk jadual.
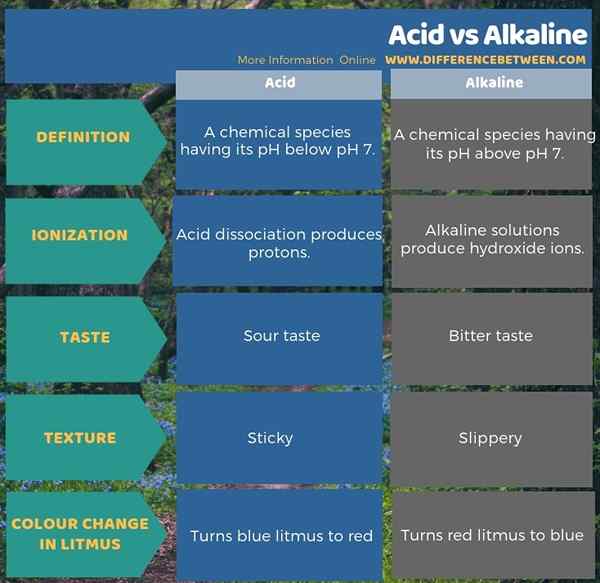
Ringkasan -Asid vs Alkali
Asid dan alkali telah menentang sifat kimia dan fizikal kerana tingkah laku kimia yang berbeza. Perbezaan utama antara asid dan alkali ialah pH asid terletak di bawah pH 7 manakala pH alkali berada di atas pH 7.
Rujukan:
1. Britannica, editor Encyclopaedia. "Asid."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 27 dec. 2017. Terdapat di sini
2. "Alkaline | Definisi Alkali dalam Bahasa Inggeris oleh Kamus Oxford."Kamus Oxford | Kamus Bahasa Inggeris, Oxford. Terdapat di sini
Ihsan gambar:
1."Kertas Litmus" oleh ChemicalInterest - Kerja Sendiri, (Domain Awam) melalui Commons Wikimedia
2."PH Scale" oleh Christinelmiller - Kerja Sendiri, (CC BY -SA 4.0) melalui Commons Wikimedia


